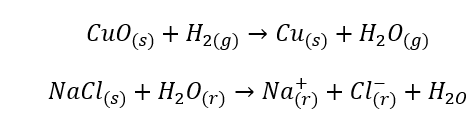Overwegingen over verschillende fenomenen en processen moeten meerlagig zijn. We moeten rekening houden met zowel de microscopische als de macroscopische eigenschappen. Zoals de namen suggereren, wordt deze indeling gemaakt door de ordes van grootte van de geanalyseerde items te scheiden. Het macroscopische domein, nauw verbonden met de thermodynamica van chemische reacties, stelt ons in staat om fysische en chemische eigenschappen zoals dichtheid, temperatuur of oplosbaarheid waar te nemen en te meten. Door microscopische analyse kunnen we de bewegingen en interacties van moleculen waarnemen. We kunnen moleculen beschrijven in termen van hun snelheid en kinetische energie. Als we geïnteresseerd zijn in een mengsel, kunnen we rekening houden met de homogeniteit ervan en bijgevolg met het type systeem waarin het bestaat.

Classificatie van fysisch-chemische systemen
Bij het analyseren van de homogeniteit van materiële systemen classificeert de macroscopische schaal ze in twee hoofdgroepen: homogene en heterogene systemen. Deze indeling is op basis van hun fysieke kenmerken: de fysieke toestand, oplosbaarheid en smeltpunt, die al dan niet kunnen verschillen. Elk systeem omvat alle stoffen die deelnemen aan een bepaalde reactie of proces. Het deel van het systeem dat zich duidelijk onderscheidt door dezelfde eigenschappen te behouden, wordt een fase genoemd. Er zijn drie verschillende soorten fasen: vast, vloeibaar en gas. Het oppervlak dat zich tussen hen en de rest van het systeem bevindt, wordt de interface genoemd. Afhankelijk van de vrije enthalpie (ΔG) of entropie (ΔS), als ΔS>0 of ΔG<0, kan de transformatie van de ene fase in de andere automatisch plaatsvinden.
Fase-evenwichtsdiagram
Een grafische weergave van het bestaan van verschillende fasen wordt het fase-evenwichtsdiagram genoemd. Het omvat het bestaan van specifieke fasen (als bepaalde temperatuur- en drukbereiken worden bereikt) en hun onderlinge omzettingen. Een schematisch fase-evenwichtsdiagram voor een systeem met één component illustreert het bestaan van drie hoofdfasen, afhankelijk van de procesomstandigheden. De lijnen die het toont, geven de evenwichtstoestanden aan tussen twee respectieve fasen, dat wil zeggen tussen vast en gas, tussen vast en vloeibaar en tussen gas en vloeistof. Dus als we een van de kritische parameters kennen, kunnen we de omstandigheden bepalen die het smelten, bevriezen, verdampen, condenseren, sublimeren of opnieuw sublimeren van het betreffende ingrediënt veroorzaken. Bovendien bevat het diagram een tripelpunt waar alle faselijnen met elkaar verbonden zijn, wat aangeeft dat alle drie de fasen naast elkaar kunnen bestaan onder gespecificeerde omstandigheden. Het diagram bevat ook twee belangrijke punten: kritische druk en kritische temperatuur. De kritische druk wordt aangegeven door het punt dat de maximale druk vertegenwoordigt waarbij we een vloeistof in een gas kunnen omzetten, of de maximaal mogelijke druk van verzadigde damp boven de vloeistof. Het concept van kritische temperatuur definieert de hoogste temperatuur waarbij een gas kan condenseren als de druk toeneemt. Daarom definieert het kritieke punt dat bestaat bij kritische temperatuur- en kritische drukomstandigheden een toestand waarin de vloeibare en gasvormige fasen onmogelijk te onderscheiden zijn.
Gibbs-faseregel
Het is een specifieke relatie die kan worden toegepast op elk systeem dat in thermodynamisch evenwicht bestaat. De vergelijking die die regel vertegenwoordigt, bevat het aantal fasen (f) aanwezig in het systeem met het aantal onafhankelijke bestanddelen (n) en het aantal vrijheidsgraden (s). Het s-getal komt overeen met de hoeveelheid instelbare intensieve variabelen die, indien gewijzigd, het aantal fasen in het evenwicht van het geïsoleerde systeem niet zullen verstoren. Intensieve variabelen zijn alle fysieke waarden die op geen enkele manier afhangen van het systeem (bijv. geometrische afmetingen of volume) of van het aantal moleculen, het gewicht, de soortelijke warmte, enz. De vergelijking is als volgt: De onafhankelijke componenten van het systeem , aangeduid als n, vertegenwoordigen praktisch het laagste aantal systeemcomponenten dat nodig is om elk van zijn fasen in een willekeurige hoeveelheid te bouwen. Als we een systeem analyseren waarvan de componenten met elkaar kunnen reageren, berekenen we de n-waarde door het aantal onafhankelijke reactievergelijkingen af te trekken van het totale aantal componenten waaruit het systeem bestaat. Dus als we de volgende notatie aannemen: ![]() het aantal onafhankelijke vergelijkingen is 1 – we onderzoeken een bepaalde reactie die in het systeem optreedt. Een onafhankelijke vergelijking is elk systeem van chemische vergelijkingen waarin het onmogelijk is om een van de vergelijkingen te verkrijgen door de andere te combineren. Terwijl het aantal componenten voor zo’n systeem 3 is: het zijn CaCO 3 , CaO en CO 2 . Met deze informatie kunnen we ook het aantal onafhankelijke componenten berekenen: n = het aantal componenten – het aantal onafhankelijke vergelijkingen, en dus: n = 3 – 1 = 2 We kunnen hetzelfde voorbeeld gebruiken om het aantal vrijheidsgraden te berekenen met behulp van de vergelijking voor de Gibbs-faseregel: s = n – f + 2 = 2 – 3 + 2 = 1 Deze waarde geeft aan dat we, om een stabiele hoeveelheid fasen in systeemevenwicht te behouden, slechts één intensieve variabele kunnen gebruiken.
het aantal onafhankelijke vergelijkingen is 1 – we onderzoeken een bepaalde reactie die in het systeem optreedt. Een onafhankelijke vergelijking is elk systeem van chemische vergelijkingen waarin het onmogelijk is om een van de vergelijkingen te verkrijgen door de andere te combineren. Terwijl het aantal componenten voor zo’n systeem 3 is: het zijn CaCO 3 , CaO en CO 2 . Met deze informatie kunnen we ook het aantal onafhankelijke componenten berekenen: n = het aantal componenten – het aantal onafhankelijke vergelijkingen, en dus: n = 3 – 1 = 2 We kunnen hetzelfde voorbeeld gebruiken om het aantal vrijheidsgraden te berekenen met behulp van de vergelijking voor de Gibbs-faseregel: s = n – f + 2 = 2 – 3 + 2 = 1 Deze waarde geeft aan dat we, om een stabiele hoeveelheid fasen in systeemevenwicht te behouden, slechts één intensieve variabele kunnen gebruiken. 
Heterogene systemen
Elk systeem dat meer dan één fase omvat (dus een niet-homogeen systeem) is ook heterogeen. Het type fasen is niet relevant; een heterogeen systeem kan tegelijkertijd meerdere vaste en vloeibare fasen bevatten, maar slechts één gasvormige fase. Dit komt door het feit dat gassen zich op een perfecte manier mengen. Een interessant voorbeeld van een heterogeen systeem is graniet – het bevat veel vaste fasen, waaronder kwarts, kaliumveldspaat, plagioklaas en biotiet. Veel voedingsproducten kunnen ook heterogeen worden genoemd, perfecte voorbeelden zijn muesli met meerdere ingrediënten of saladesauzen die bestaan uit vet, kruiden en andere toevoegingen. Een interessant type niet-homogene mengsels zijn colloïden (oplossingen waarvan de bestanddelen alleen met een microscoop kunnen worden onderscheiden). In de meeste gevallen kunnen ze echter worden gescheiden met eenvoudige methoden of hulpmiddelen. Om bijvoorbeeld een mengsel van water en olie te scheiden, kunnen we decanteren gebruiken – de ingrediënten zijn zichtbaar voor het blote oog. Andere methoden die we kunnen gebruiken om niet-homogene mengsels effectief te scheiden, zijn: filtratie, mechanische segregatie of centrifugatie. Hetzelfde geldt voor een mengsel van mineralen die verschillen in eigenschappen: kwarts, mica en veldspaat kunnen zelfs met een hamer worden gescheiden.
Homogene systemen
In tegenstelling tot heterogene systemen wordt een homogeen systeem gekenmerkt door de aanwezigheid van slechts één fase. In zo’n geval kunnen we de bestanddelen niet met het blote oog onderscheiden. Eenvoudige scheidingsmethoden zijn ook niet effectief, en alleen methoden op basis van fysieke kenmerken kunnen nuttig blijken te zijn. Een voorbeeld van zo’n methode is de scheiding door destillatie, die is gebaseerd op verschillende kookpunten van een specifiek systeem. Andere methoden die effectief zijn bij het scheiden van homogene mengsels zijn kristallisatie en chromatografie. Een speciaal type van een homogeen systeem is een zuivere stof waarvan de enige fase slechts één component bevat. Een ander voorbeeld zijn alle soorten homogene oplossingen en mengsels – ondanks de aanwezigheid van slechts één fase kan het systeem vele componenten bevatten. Aangezien de in het systeem aanwezige fase een vloeistof, een vaste stof of een gas kan zijn, kunnen oplossingen ook dergelijke vormen aannemen. Voorbeelden van dergelijke systemen zijn vloeibare mengsels (azijn, water), gasvormige mengsels (atmosferische lucht) en vaste mengsels, waaronder minerale ertsen en alle soorten legeringen, zoals brons of messing.
Overgangen in systemen
Er kunnen twee soorten overgangen in systemen voorkomen, dit zijn fase- (soms fysische genoemd) en chemische overgangen. De eerste omvatten alle overgangen die geen nieuwe chemische stoffen produceren. Ze worden ook niet gekenmerkt door het vervagen van de reeds aanwezige componenten. Zoals de naam al aangeeft, leiden ze echter tot dergelijke veranderingen in de structuur of de fysieke toestand. Het is ook mogelijk dat er een nieuwe fase ontstaat terwijl de oorspronkelijke fase uitsterft. Voorbeelden van faseovergangen zijn resublimatie en polymorfe overgangen van elementen. Chemische overgangen laten een heel ander mechanisme zien. Dit zijn reacties waarbij nieuwe stoffen ontstaan die de oorspronkelijke bestanddelen vervangen. Dergelijke overgangen kunnen in twee varianten worden uitgevoerd, bijvoorbeeld tijdens hydrolyse in een of meer fasen en tijdens verbranding.
Chemische reacties
- Homogene reacties treden op wanneer het gehele systeem, inclusief substraten en producten, zich in één fase bevindt, bijvoorbeeld:
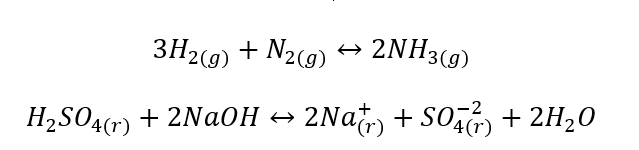
- Heterogene reacties zijn reacties waarbij het systeem, inclusief substraten en producten, zich ten minste in twee verschillende fasen bevindt. Dergelijke reacties vinden altijd plaats op de interface, bijvoorbeeld: