In de chemie vormen sommige chemische verbindingen speciale bindingen met watermoleculen. Dit zijn geen chemische bindingen, maar korteafstandsinteracties die specifiek de eigenschappen van deze verbindingen bepalen. We hebben het over hydraten. Hun eigenschappen worden gemakkelijk gebruikt in geselecteerde industriële sectoren. Het populairste gehydrateerde zout is ongetwijfeld gips, oftewel calciumsulfaatdihydraat (VI), een belangrijke grondstof in de bouwsector. Hydraten zijn ook zeer goede indicatoren voor het vochtgehalte. Dit hangt samen met het feit dat de kleur van het watervrije zout vaak verschilt van die van het gehydrateerde zout.

Hydrateert
Hydraten zijn geen chemische verbindingen waarin chemische bindingen , zoals covalente bindingen , voorkomen tussen de watermoleculen en de moleculen van het gegeven zout . Het zijn ook geen coördinatieverbindingen. Kenmerkend voor deze structuren is de vorming van waterstofbruggen, die veel zwakker van sterkte zijn dan chemische bindingen. Hydraten zijn gestructureerd in de vorm van een kristalrooster. De watermoleculen zijn daarin onregelmatig verdeeld. Vaak wordt de term “kristallisatiewater” gebruikt. Hydraten worden verkregen door hydratatie . Zoutmoleculen, vooral anorganische zuurderivaten, zullen deze reactie het meest waarschijnlijk ondergaan. Hydratatie omvat de transformatie van watervrije kristallen in gehydrateerde kristallen. Het kan een verandering in de minerale massa veroorzaken, maar vernietigt deze niet. Hydratatie gaat vaak samen met andere processen, zoals carbonatatie. Hydratatiechemicaliën worden onder normale omstandigheden gekenmerkt door een hoge hygroscopiciteit , dat wil zeggen een sterke affiniteit voor watermoleculen. Dergelijke stoffen zijn bijvoorbeeld in staat vocht uit de lucht op te nemen . Een andere manier om hydraten te verkrijgen is door ze uit waterige oplossingen te kristalliseren. De molecuulformules van hydraten worden gevormd door de zoutformule op te schrijven en het aantal gehydrateerde watermoleculen te vermelden. Om een algemene notatie te geven, wordt de letter ‘n’ vóór ‘H 2 O’ geplaatst. De waarden zijn groter dan één en komen overeen met het aantal aangehechte watermoleculen. Het meest voorkomende onderscheid is tussen hydraten met n=½ (hemihydraat), n= 1 (monohydraat), n=2 (dihydraat) en n=3 (trihydraat). Belangrijk is dat dezelfde stof verschillende aantallen watermoleculen kan hechten. ![]()
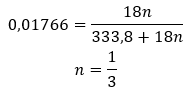 Gegeven het feit dat er waterstofbruggen bestaan tussen de zoutmoleculen en de watermoleculen, vertonen deze verbindingen geen bevredigende weerstand tegen verhoogde temperaturen. Wanneer ze worden verwarmd, vallen ze uiteen en veranderen ze in watervrije vormen. Hydraten lossen zeer goed op in water. In waterige oplossingen komen gehydrateerde watermoleculen vrij die aan het zout zijn gehecht. Met dit feit moet bijvoorbeeld rekening worden gehouden bij het maken van oplossingen van deze stoffen. Als er geen rekening wordt gehouden met de mate van hydratatie van een bepaalde verbinding, leidt dit tot fouten, al was het maar bij het bepalen van de concentratie van de oplossing. Een belangrijk kenmerk van gehydrateerde zouten is de verandering in hun kleur als gevolg van de aanhechting van watermoleculen in de hydratatiereactie. Opgemerkt moet worden dat de gehydrateerde vormen aanzienlijk minder hygroscopiciteit vertonen vergeleken met de watervrije zouten.
Gegeven het feit dat er waterstofbruggen bestaan tussen de zoutmoleculen en de watermoleculen, vertonen deze verbindingen geen bevredigende weerstand tegen verhoogde temperaturen. Wanneer ze worden verwarmd, vallen ze uiteen en veranderen ze in watervrije vormen. Hydraten lossen zeer goed op in water. In waterige oplossingen komen gehydrateerde watermoleculen vrij die aan het zout zijn gehecht. Met dit feit moet bijvoorbeeld rekening worden gehouden bij het maken van oplossingen van deze stoffen. Als er geen rekening wordt gehouden met de mate van hydratatie van een bepaalde verbinding, leidt dit tot fouten, al was het maar bij het bepalen van de concentratie van de oplossing. Een belangrijk kenmerk van gehydrateerde zouten is de verandering in hun kleur als gevolg van de aanhechting van watermoleculen in de hydratatiereactie. Opgemerkt moet worden dat de gehydrateerde vormen aanzienlijk minder hygroscopiciteit vertonen vergeleken met de watervrije zouten.
Hydraten van anorganische verbindingen
Zouten van anorganische zuren zijn stoffen waarvan de kans het grootst is dat ze hydraten vormen met watermoleculen. De meest voorkomende hydraten van anorganische verbindingen zijn onder meer:
- Koper (II) sulfaathydraat (VI), CuSO 4 – koper (II) sulfaat (VI) kent verschillende hydratatiegraden. Het maximale aantal bevestigde watermoleculen is vijf. Door het pentahydraat van dit zout te verwarmen, worden watermoleculen afgestript. Eerst worden er twee en een trihydraat gevormd, en bij verdere verwarming van het systeem kan koper(II)sulfaatmonohydraat (VI) worden verkregen. Om het laatste watermolecuul te verwijderen is het nodig om de verbinding te verwarmen tot een temperatuur van ruim 200 ᵒC. Koper(II)sulfaathydraten (VI) zijn blauw van kleur, wat wordt veroorzaakt door de aanwezigheid van kristallisatiewater rond de koperionen. Terwijl watervrij zout wit van kleur is. De hoge hygroscopiciteit en het vermogen om hydraten te vormen wordt gebruikt om vocht uit sommige vloeistoffen te verwijderen.
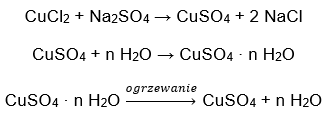
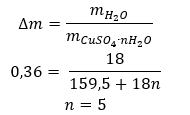
- Kobalt (II) chloridehydraat, CoCl 2 – watervrij kobalt (II) chloride is zeer hygroscopisch. Dankzij zijn sterke affiniteit voor watermoleculen is het in staat zelfs vocht uit de lucht op te nemen. Dit proces resulteert in de vorming van hydraten van dit zout. De meest voorkomende gehydrateerde vorm is kobalt(II)chloride-hexahydraat – CoCl 2 * 6H 2 Een andere vorm is het dihydraatmolecuul. Dit zout vertoont ook het vermogen om van kleur te veranderen afhankelijk van het vochtgehalte. Watervrij zout is blauw, dihydraat krijgt een roze-paarse kleur en de kleur van het hexahydraatmolecuul is intens rood.
- Natriumsulfaathydraat (VI), Na 2 SO 4 – dit zout bestaat in de vorm van twee hydraten: heptahydraat (vijf watermoleculen in de structuur) en decahydraat (tien watermoleculen in de structuur). De watervrije vorm van natriumsulfaat (VI) komt in de natuur voor als het zeldzame mineraal thénardiet. Natriumsulfaat-ten-hydraat (VI) is het zogenaamde Glauber-zout. Het wordt veel gebruikt bij de productie van glas, papier, wasmiddel en frisdrank. Glauberszout is ook een van de ingrediënten die nodig zijn voor de productie van het blauwe pigment ultramarijn. Bovendien heeft de verbinding een therapeutisch effect op het spijsverteringsstelsel vanwege de laxerende eigenschappen.

Gips
Een voorbeeld van een anorganisch zouthydraat van mondiaal belang en brede toepassing is gips. Het is een mineraal dat bestaat uit de gehydrateerde vorm van calciumsulfaat (VI), CaSO 4 . Kristallijn gips is het dihydraat van dit zout. Onder natuurlijke omstandigheden wordt het gevormd tijdens de verdamping van zout water uit meren en rivieren, bij temperaturen onder de 42ᵒC. Watervrij calciumsulfaat (VI) is anhydriet. Het wordt ook wel watervrij gips genoemd. Gips bouwen daarentegen is calciumsulfaathemihydraat (VI). Welke vorm van dit zout wordt verkregen, hangt af van de temperatuur die heerst tijdens de verwerking van het moederafzettingsgesteente. Gips dat in de bouw wordt gebruikt, is meestal een mengsel van verschillende vormen van gehydrateerd kalkzout. 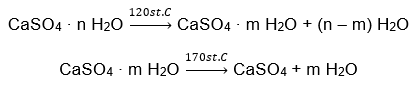
 De toepassingsmogelijkheden van gips zijn zeer breed, vooral in de bouwsector. De belangrijkste toepassingen van dit zouthydraat staan hieronder vermeld:
De toepassingsmogelijkheden van gips zijn zeer breed, vooral in de bouwsector. De belangrijkste toepassingen van dit zouthydraat staan hieronder vermeld:
- In de bouwsector wordt gips gebruikt in afwerkingselementen. Het is een van de componenten van losse halffabrikaten, mortels, lijmen, gipsafwerking en kant-en-klare montagecomponenten, bijvoorbeeld gipsplaat.
- De geneeskunde gebruikt gips om gebroken ledematen te ondersteunen. Gipsverbanden worden als huidvriendelijk beschouwd. Daarnaast wordt het materiaal ook gebruikt in tandtechnische laboratoria.
- De industrie gebruikt gips in modellerings- en ontwerpworkshops. Gipsafgietsels zijn zeer geschikt voor het vormgeven van diverse gebruiksvoorwerpen.
- Gips is een additief voor sommige meststoffen die in de landbouw worden gebruikt.

Methaan clathraten
Methaanclathraten behoren tot een groep verbindingen die bekend staat als gashydraten. Zij zijn verantwoordelijk voor het grootste deel van de snelle klimaatverandering in de geschiedenis van de aarde. Methaanclathraten worden ook vaak methaanhydraten of methaanijs genoemd. Ze vormen een vaste vorm van water en methaan . Hun moleculen onderscheiden zich door hun kristallijne structuur. Ze worden gevormd onder verhoogde druk. Ze nemen de vorm aan van witte, geurloze vaste stoffen, die qua uiterlijk vaak lijken op ijs. Interessant genoeg lijken ze bij aanraking op polystyreen . Clathraten zijn unieke chemische groepen . Watermoleculen vormen een structuur die op een kooi lijkt. In deze kooi wordt methaan opgeslagen. Belangrijk is dat de twee stoffen geen chemische bindingen met elkaar vormen. Typisch bestaan methaanclathraten uit 46 watermoleculen die twee kleine en zes middelgrote kooien omringen. Daarin zitten methaanmoleculen gevangen. Het is ook bekend dat clathraten bestaan uit 136 watermoleculen met daarin 16 kleine en acht grote kooien met methaangas. De afgelopen jaren zijn aanzienlijke hoeveelheden van deze hulpbron ontdekt op de bodem van de oceanen. Er is veel belangstelling voor vanwege de potentie om aanzienlijke hoeveelheden methaan te winnen, die bijvoorbeeld voor energiedoeleinden kunnen worden gebruikt. Methaanclathraten branden met een gelijkmatige vlam en zijn roodachtig van kleur. Na het verbranden blijft er gesmolten water achter. Op deze manier gewonnen methaan kan een goed alternatief zijn voor conventionele koolwaterstofbronnen , maar vormt ook een behoorlijke bedreiging voor het klimaat. Er is nog steeds onvoldoende kennis over de exploitatie van methaan uit clathraten die zich op de oceaanbodem hebben opgehoopt. Het ongecontroleerd vrijkomen van aanzienlijke hoeveelheden van dit gas kan zeer gevaarlijk zijn, omdat het het broeikaseffect veel sterker versterkt dan kooldioxide.
