Het is een van de twee hoofdafdelingen van de analytische chemie, die zich bezighoudt met het detecteren van chemische elementen, functionele groepen of ionen die in de geteste structuur voorkomen. Qua gebruikte methoden kunnen we chemische analyse indelen in klassieke analyse en instrumentele analyse. Klassieke analyse is gebaseerd op methoden die zijn gebaseerd op chemische reacties die kunnen worden uitgevoerd in "droge" of "natte" modus. Instrumentele analyse steunt daarentegen op instrumenten, dat wil zeggen analytische meetinstrumenten met als belangrijkste element de detector.

Klassieke analyse: droge reacties
De term "droge reacties" verwijst naar de veranderingen die optreden in chemische verbindingen terwijl ze worden blootgesteld aan hoge temperaturen. We onderscheiden drie hoofdtypen van dergelijke reacties:
- het geteste monster smelten met vaste fluxen,
- het verkrijgen van borax of microkosmische zoutparels,
- kleuren van de vlam van de gasbrander.
De meest populaire is de derde methode, die de vlamtest wordt genoemd en waarmee veel elementen kunnen worden gedetecteerd. Dit is een voorbeeld van een techniek die gebruik maakt van stralingsemissie. Het bestaat uit het onderzoeken van de karakteristieke straling die wordt uitgezonden door de atomen van bepaalde elementen zodra ze worden geëxciteerd door hoge temperatuur. Dit komt omdat is aangetoond dat dergelijke omstandigheden verdamping van de verbindingen van bepaalde metalen veroorzaken, en de geproduceerde dampen worden geëxciteerd en kleuren de vlam van de brander op een karakteristieke manier. De kleur is een effect van de excitatie van bepaalde atomen die, terwijl ze in hun oorspronkelijke staat worden hersteld, een lichtkwantum uitzenden dat verwijst naar een bepaalde golflengte. De vlamkleuren die kenmerkend zijn voor bepaalde elementen zijn bijvoorbeeld als volgt:
- natrium: intensief geel,
- kalium: violet,
- calcium: steenrood,
- barium: groen,
- bismut: lichtblauw.
Klassieke analyse: natte reacties
Dit zijn alle soorten reacties die optreden tussen de geteste monsters en oplossingen van verschillende chemische reagentia . Om dergelijke reacties uit te voeren, moet de geteste stof worden omgezet in een oplossing. De toegepaste reacties worden geselecteerd op basis van vele criteria, zodat ze:
- een hoge gevoeligheid vertonen, dwz al optreden bij lage concentraties van de stof die wordt gedetecteerd;
- in korte tijd optreden en gemakkelijk waarneembare veranderingen vertonen, zoals een verandering in de kleur van de oplossing, in neerslag of in gasemissie;
- zijn selectief, dwz komen alleen voor binnen een bekende groep ionen.

Kwalitatieve analyse: anorganische chemie
In de anorganische chemie draait kwalitatieve analyse om twee onderwerpen: de detectie van kationen en anionen. Anorganische chemie maakt gebruik van karakteristieke reacties waarbij geschikte groepsreagentia betrokken zijn. Ze worden "groepsreagentia" genoemd omdat de kationen zijn onderverdeeld in vijf categorieën. Zo’n reagens vormt sedimenten met slechts één ervan, wat het mogelijk maakt om de soorten kationen die in het monster aanwezig zijn te beperken volgens het volgende patroon:
- Groep 1: Ag + , Hg 2 2+ , Pb 2+ – groep reagens 3M HCl;
- Groep 2: Hg 2+ , Cu 2+ , Cd 2+ , Bi 3+ , As 3+ , As 5+ , Sb 3+ , Sb 5+ , Sn 2+ , Sn 4+ – groep reagens H 2 S in een 1M HCl-omgeving;
- Groep 3: Ni 2+ , Co 2+ , Fe 2+ , Fe 3+ , Mn 2+ , Zn 2+ , Al 3+ , Cr 3+ – groepsreagens (NH 4 ) 2 S in een ammoniumbufferomgeving;
- Groep 4: Ca 2+ , Sr 2+ , Ba 2+ – groep reagens (NH 4 ) 2 CO 3 in een ammoniumbufferomgeving;
- Groep 5: Mg 2+ , Na + , K + , NH 4 + – geen groepsreagens.
Zodra we bepaalde groepen kationen hebben uitgesloten, kunnen we de identificatie voortzetten met het gebruik van andere reagentia, deze keer die kenmerkend zijn voor bepaalde ionen. Een dergelijke reactie maakt een eenduidige identificatie mogelijk. De detectie van Ag + -ionen in een monster gebeurt bijvoorbeeld in twee fasen:
- De reactie met een groepsreagens: productie van een wit sediment
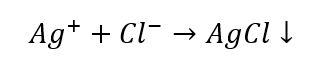
- De karakteristieke reactie: het AgCl-sediment oplossen in een waterige ammoniakoplossing, waarbij een kleurloze complexe verbinding wordt verkregen.
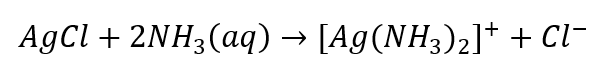
We kunnen anionen, die in drie groepen zijn verdeeld, op een vergelijkbare manier identificeren:
- Groep 1: BO 2 – , CO 3 2- , C 2 O 4 2- , SiO 3 2- , PO 4 3- , AsO 3 3- , AsO 4 3- , SO 3 2- , S 2 O 3 2- , SO 4 2- , F – , CrO 4 2- , Cr 2 O 7 2- – groep reagens BaCl 2 , de vorming van zouten slecht oplosbaar in water;
- Groep 2: C 4 H 4 O 6 2- , S 2- , Cl – , ClO – , Br – , I – , CN – , SCN – – groep reagens AgNO 3 , de vorming van zouten matig oplosbaar in water en in verdunde salpeterzuur;
- Groep 3: CH 3 COO – , NO 2 – , NO 3 2- , ClO 3 – , ClO 4 – , MnO 4 – – de groepsreagens bevat zilver- of bariumkationen; de vorming van in water oplosbare zouten.
De identificatie van kationen is iets problematischer in vergelijking met anionen, aangezien de volgorde van procedures afhangt van de resultaten van groepsreacties, en er zijn ionen die het identificatieproces verstoren. Om bijvoorbeeld een CO 3 2 -ion te detecteren moeten we de volgende reacties uitvoeren:
- De Ba 2+ -ionen produceren een wit sediment dat oplosbaar is in zuren
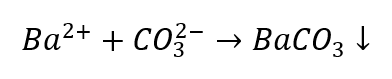
- Verdunde zuren veroorzaken ontleding met CO 2 -precipitatie
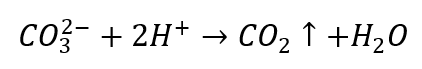
- Kooldioxide zorgt ervoor dat de oplossing borrelt. Het kan worden bedekt met kalkwater, omdat het witte sediment zal neerslaan.
* Storende ionen: SO 3 2- en S 2 O 3 2- vormen ook witte sedimenten met het calciumkation. Ze moeten worden geoxideerd om de verstoring op te heffen. 
Kwalitatieve analyse: organische chemie
De kwalitatieve analyse van organische verbindingen omvat meerdere fasen en het belangrijkste punt is om vijf fundamentele problemen op te lossen:
- Analyse van fysische parameters zoals het smelt- of kookpunt. Helaas zijn er veel chemische verbindingen met dezelfde temperatuurpunten en kan de meting zelf door fouten worden beïnvloed. Als we echter een geschikte referentiestandaard hebben, kan deze methode ons in staat stellen de verbinding snel te identificeren. Bovendien kunnen we door de temperaturen te meten de zuiverheid van de verbinding bepalen, aangezien de temperatuurbereiken smal zijn. De constantheid van Ttop na ten minste één kristallisatie kan ook wijzen op een hoge zuiverheid van de verbinding. Voor vloeistoffen kan dit een smal destillatiebereik aangeven.
- Het testen van de elementaire samenstelling kan de aanwezigheid van bepaalde soorten organische verbindingen uitsluiten of bevestigen. Om een voorbeeld te geven: door de aanwezigheid van stikstofatomen in de structuur uit te sluiten, sluiten we ook de aanwezigheid van amino- of nitraatgroepen uit. Hiervoor voeren we karakteristieke experimenten uit, zoals de test van Lassaigne voor stikstof, de test van Beilstein voor halogenen of de zwaveltest met natriumnitroprusside.
- Door de oplosbaarheid van de verbinding te testen, kunnen we deze indelen in de groep verbindingen met gespecificeerde chemische eigenschappen. Volgens het principe "like lost like" zijn verbindingen onderverdeeld in 7 categorieën.
- Identificatie van functionele groepen vereist passende analytische reacties die het mogelijk maken functionele groepen uit te sluiten of te identificeren.
- Spectrale analyse is het meest betrouwbare punt waarmee we een chemische verbinding duidelijk kunnen identificeren. Het behandelt alle instrumentale technieken, zoals:
- Massaspectrometrie (MS) , die bestaat uit het ioniseren van de moleculen en het detecteren van het aantal ionen door hun massa-ladingverhouding te bepalen. Dit stelt ons in staat conclusies te trekken over de massa van de geanalyseerde verbinding;
- Nucleaire magnetische resonantie (NMR) spectroscopie , die specifieke informatie over de structuur levert. Het geeft een beeld van magnetische kernen ( 13 C, 1 H), wat een grondige interpretatie van hun kwaliteit mogelijk maakt;
- Infrarood (IR) spectroscopie maakt gebruik van een smal bereik van elektromagnetische straling om de soorten trillingen in het geteste molecuul weer te geven.
