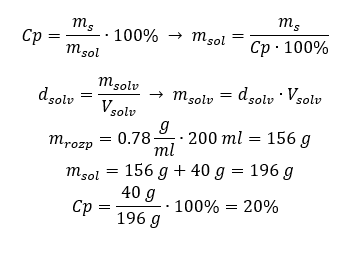In de chemie gebruiken we vaak termen als "geconcentreerde oplossing", "verdunde oplossing" of "verzadigde oplossing", maar ze geven ons slechts een basisoverzicht of de oplossing een grote of een kleine hoeveelheid van een bepaalde stof bevat. Er zijn echter enkele methoden die ons helpen de kwantitatieve samenstelling van een bepaalde oplossing nauwkeurig te bepalen. Een ervan wordt in het volgende artikel besproken.

Definitie van procentuele concentratie
De term "concentratie" verwijst naar een maat voor de hoeveelheid van een bepaalde stof in een bepaalde oplossing . Concentratie kan worden uitgedrukt in eenheden op basis van de maten die we gebruiken, bijvoorbeeld in mollen, grammen of in procenten. Percentage concentratie geeft aan hoeveel delen per massa van de opgeloste stof zijn opgenomen in 100 delen per massa van de oplossing. Met andere woorden, het is het aantal gram opgeloste stof in 100 g oplossing. Als we bijvoorbeeld melk kopen met het label 3,2%, betekent dit dat 100 g melk 3,2 g vet bevat. Procentuele concentratie wordt afgekort als Cp.
Algemene formule van procentuele concentratie
Om de formule voor procentuele concentratie af te leiden, moet men onthouden dat de massa van een oplossing (m sol ) niet alleen de massa van het oplosmiddel (m solv ) bevat, maar ook de massa van de opgeloste stof (m s ) : m sol = m solv + m s Als we bijvoorbeeld een 4%-oplossing nemen met een massa van 100 g, weten we dat Cp = 4%, dus de massa van de stof is 4 g. De definitie van concentratiepercentage geeft aan dat als de massa van de oplossing 100 g is, de massa van het oplosmiddel 96 g is. Percentage concentratie kan worden berekend met de volgende formule: Cp = (m s /m sol ) · 100%Zoals we uit de formule kunnen zien, kunnen we, als we de massa van de oplossing en de massa van de stof kennen, eenvoudig de procentuele concentratie. Als we bijvoorbeeld weten dat de oplossing 450 g weegt en de opgeloste stof 15 g, dan verkrijgen we door deze getallen in de formule in te voegen het volgende: Cp = (15/450) · 100%= 3,3%
Berekening van de massa van individuele ingrediënten in een oplossing
Elke formule, inclusief die voor procentuele concentratie, kan opnieuw worden gerangschikt. Als we de massa en de procentuele concentratie van de oplossing kennen, kunnen we de massa van de opgeloste stof berekenen. Evenzo, als we de procentuele concentratie en de massa van de stof kennen, kunnen we de massa van de oplossing berekenen. Naast het herschikken van de formule, kunnen we ook de juiste verhoudingen gebruiken. Voorbeeld 1. Hoeveel gram suiker hebben we nodig om 300 g van een 10%-oplossing te bereiden? We weten uit de instructies dat de massa van de oplossing 300 g is en dat de procentuele concentratie 10%is. De massa van de opgeloste stof kan op twee manieren worden bepaald. Methode 1. De formule herschikken 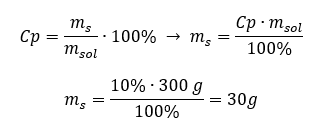 Methode 2. De verhoudingen gebruiken , wetende dat de 10%oplossing 10 g suiker bevat in 100 g van de oplossing:
Methode 2. De verhoudingen gebruiken , wetende dat de 10%oplossing 10 g suiker bevat in 100 g van de oplossing: 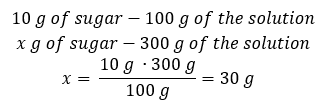 Beide methoden leiden tot de conclusie dat voor de bereiding van 300 g van een 10%-oplossing 30 g suiker nodig is.
Beide methoden leiden tot de conclusie dat voor de bereiding van 300 g van een 10%-oplossing 30 g suiker nodig is.  Voorbeeld 2. In hoeveel gram water moeten we 10 g van een stof oplossen om een 50%oplossing te krijgen? We weten uit de instructies dat de massa van de stof 10 g is en dat de procentuele concentratie van de oplossing 50%is. Dit houdt in dat 100 g van de oplossing 50 g van de stof bevat. De massa van de oplossing kan op twee manieren worden bepaald. Houd er rekening mee dat de massa van de oplossing niet gelijk is aan de massa van het oplosmiddel. Om de massa van het oplosmiddel te berekenen, moeten we de massa van de stof aftrekken van de massa van de oplossing. Methode 1. De formule herschikken
Voorbeeld 2. In hoeveel gram water moeten we 10 g van een stof oplossen om een 50%oplossing te krijgen? We weten uit de instructies dat de massa van de stof 10 g is en dat de procentuele concentratie van de oplossing 50%is. Dit houdt in dat 100 g van de oplossing 50 g van de stof bevat. De massa van de oplossing kan op twee manieren worden bepaald. Houd er rekening mee dat de massa van de oplossing niet gelijk is aan de massa van het oplosmiddel. Om de massa van het oplosmiddel te berekenen, moeten we de massa van de stof aftrekken van de massa van de oplossing. Methode 1. De formule herschikken 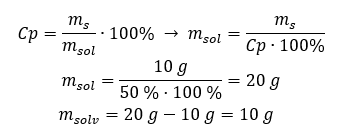 Methode 2. De verhoudingen gebruiken , wetende dat 100 g van de oplossing 50 g van de stof bevat.
Methode 2. De verhoudingen gebruiken , wetende dat 100 g van de oplossing 50 g van de stof bevat. 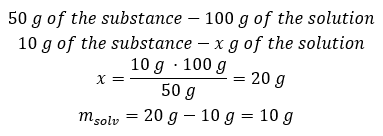 Ongeacht de methode die we gebruiken, het antwoord zal zijn dat we, om een oplossing van 50%te verkrijgen, 10 g van de stof moeten oplossen in 10 g water.
Ongeacht de methode die we gebruiken, het antwoord zal zijn dat we, om een oplossing van 50%te verkrijgen, 10 g van de stof moeten oplossen in 10 g water.
Oplossingen voorbereiden
Een sleutelelement van het werk in een laboratorium is de kennis van het bereiden van oplossingen met bepaalde concentraties. Daarvoor moeten we de massa van de ingrediënten kennen. Een eerder berekende massa van een stof moet worden opgelost in een nauwkeurig afgemeten hoeveelheid oplosmiddel. Het benodigde volume kan worden berekend als we de massa en dichtheid van de vloeistof kennen. Oplossingsdichtheid is een fysieke waarde die specifiek is voor elke vloeistof, die de massa van de oplossing per volume-eenheid definieert. Die waarde hangt nauw samen met de temperatuur. Als we weten dat de dichtheid van de oplossing 2,03 g/ml is, dan weten we ook dat 1 ml van de oplossing 2,03 g weegt. We gebruiken meestal de volgende eenheden van dichtheid: g/ml = g/cm 3 , g/l = g/dm 3 , maar we kennen er ook andere, zoals kg/m 3 . De dichtheid van de oplossing wordt berekend met de volgende formule: dsol = msol / vsol , waarbij msol de massa van de oplossing is en Vsol de dichtheid. Als we het volume en de dichtheid van de oplossing kennen, kunnen we de massa ervan berekenen. Voorbeeld 3. Wat is de massa van 20 ml van een oplossing met een dichtheid van 1,201 g/ml? Methode 1. De formule herschikken 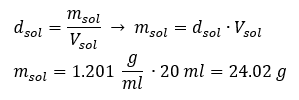 Methode 2. De verhoudingen gebruiken , wetende dat 1,201 g van de oplossing een volume heeft van 1 ml
Methode 2. De verhoudingen gebruiken , wetende dat 1,201 g van de oplossing een volume heeft van 1 ml 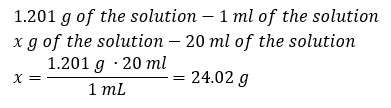 Beide methoden hebben aangetoond dat de oplossing met een dichtheid van 1,201 g/ml en een volume van 20 ml een massa heeft van 24,02 g. Als we de dichtheid kennen, kunnen we nog meer berekeningen uitvoeren in het kader van procentuele concentratie. Voorbeeld 4. Hoeveel gram zout zit er in 10 ml van een 15%-oplossing als de dichtheid 1,035 g/ml is? Methode 1. De formules herschikken
Beide methoden hebben aangetoond dat de oplossing met een dichtheid van 1,201 g/ml en een volume van 20 ml een massa heeft van 24,02 g. Als we de dichtheid kennen, kunnen we nog meer berekeningen uitvoeren in het kader van procentuele concentratie. Voorbeeld 4. Hoeveel gram zout zit er in 10 ml van een 15%-oplossing als de dichtheid 1,035 g/ml is? Methode 1. De formules herschikken 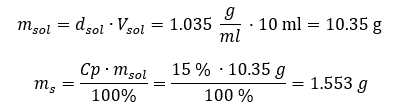 Methode 2. De verhoudingen gebruiken
Methode 2. De verhoudingen gebruiken 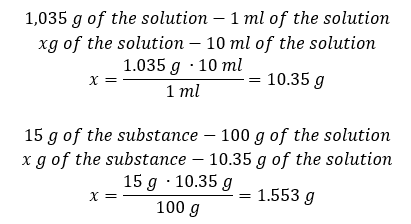 Beide methoden hebben aangetoond dat om 10 ml van een oplossing met Cp = 15%en een dichtheid van 1,035 g/ml te bereiden, we 1,553 g zout moeten afwegen. Voorbeeld 5. Wat is het concentratiepercentage van een oplossing die wordt verkregen door 40 g van een stof op te lossen in 200 ml ethanol met een dichtheid van 0,78 g/ml? Om de berekening te maken, kunnen we de formule voor procentuele concentratie gebruiken. De oplossingsmassa kan worden berekend door de massa’s van de opgeloste stof en het oplosmiddel bij elkaar op te tellen. De massa van het oplosmiddel is onbekend, maar we kennen de dichtheid en het volume, dus de ontbrekende gegevens kunnen worden berekend door de formule voor dichtheid te herschikken.
Beide methoden hebben aangetoond dat om 10 ml van een oplossing met Cp = 15%en een dichtheid van 1,035 g/ml te bereiden, we 1,553 g zout moeten afwegen. Voorbeeld 5. Wat is het concentratiepercentage van een oplossing die wordt verkregen door 40 g van een stof op te lossen in 200 ml ethanol met een dichtheid van 0,78 g/ml? Om de berekening te maken, kunnen we de formule voor procentuele concentratie gebruiken. De oplossingsmassa kan worden berekend door de massa’s van de opgeloste stof en het oplosmiddel bij elkaar op te tellen. De massa van het oplosmiddel is onbekend, maar we kennen de dichtheid en het volume, dus de ontbrekende gegevens kunnen worden berekend door de formule voor dichtheid te herschikken.