De term "pH-buffers" verwijst naar dergelijke waterige oplossingen die hun pH-waarde niet veranderen ondanks toevoeging van een kleine hoeveelheid basen of zuren, of tijdens verdunning. In de praktijk zijn het mengsels van oplossingen van zwakke zuren en hun zouten met geconcentreerde sterke basen (protondonor-protonacceptor) of, analoog, mengsels van oplossingen van zwakke basen en hun zouten met sterke zuren. Het belangrijkste doel van het gebruik van bufferoplossingen is dat ze fungeren als middelen die het mogelijk maken de pH-waarde op een redelijk stabiel niveau te houden. Ze worden vaak gebruikt in een breed scala aan chemische toepassingen, bijvoorbeeld bij de kleurstofproductie, tijdens fermentatieprocessen, maar ook om de pH-waarde van voedingsmiddelen, cosmetica en farmaceutische producten te bepalen.
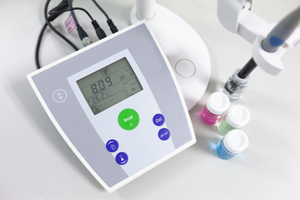
De Henderson-Hasselbach-vergelijking
De belangrijkste afhankelijkheid van de pH-waarde van de buffer van de pKa of pKb gebruikt voor respectievelijk het zuur of de base, evenals de verhouding van de concentraties van het zuur en zijn geconjugeerde base of, analoog, de base en zijn geconjugeerde zuur, is gedefinieerd door de Henderson-Hasselbach-vergelijking. Het toont de correlatie tussen de sterkte van het toegepaste zuur en de pH-waarde. Voor een monsterreactie van een buffer geproduceerd met een zwak zuur, is de procedure als volgt: HA + H 2 O ↔ H 3 O + + A – Terwijl de correlatie tussen [A –], dat is de molaire concentratie van de geconjugeerde base [mol ·dm -3], [HA], zijnde de molaire concentratie van het niet-gedissocieerde zuur en de pKa – de negatieve logaritme van de evenwichtsdissociatieconstante van het zuur (Ka), uitgedrukt met de Henderson-Hasselbach-vergelijking voor zo’n reactie, heeft de volgende vorm: 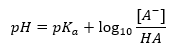
De Henderson-Hasselbach-vergelijking voor een acetaatbuffer
Het werkingsmechanisme van buffers is gebaseerd op de aanwezigheid van ionen, die waterstof- of hydroxide-ionen kunnen binden. Bij het overwegen van een acetaatbuffer, die een mengsel is van azijnzuur en natriumacetaat, moeten we de dissociatiereactie noteren tussen een zwak azijnzuur en een sterke elektrolyt, natriumacetaat (CH 3 COONa), die volledig is gedissocieerd in ionen: CH 3 COOH ↔ H + + CH 3 COO – CH 3 COONa → CH 3 COO – + Na + Aangezien de bufferoplossing een mengsel is van deze ionen, introduceert de toevoeging van een kleine hoeveelheid van een sterk zuur [H + } } ionen, die onmiddellijk worden gebonden door CH 3 COO – anionen om azijnzuur te vormen dat onder deze omstandigheden niet-gedissocieerd is. Dit verlaagt dus wel de pH-waarde. Op dezelfde manier zal de toevoer van extra OH – kationen door het toevoegen van een sterke base aan de oplossing de pH-waarde niet verhogen. Ze zullen onmiddellijk worden gebonden door H + -ionen afkomstig van de dissociatie van het azijnzuur in niet-gedissocieerde watermoleculen. De vergelijking die de zuurdissociatieconstante definieert, wordt hieronder weergegeven: 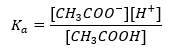 Voor de dissociatie van zwak azijnzuur wordt de totale concentratie van het CH 3 COO – anion bepaald door de concentratie van ionen afkomstig van de dissociatie van het zout, die op zijn beurt gelijk is aan de concentratie van het zout (c s ), dat is natriumacetaat. Een hoge concentratie van deze anionen zorgt ervoor dat de concentratie van H + kationen afneemt en dientengevolge wordt de zuurdissociatiegraad verlaagd om de K a -waarde stabiel te houden. Vanwege deze relatie kunnen we ook aannemen dat het aantal niet-gedissocieerde CH3COOH – moleculen praktisch identiek is aan de totale concentratie azijnzuur ( ck ). Daarom kan de dissociatieconstante als volgt worden genoteerd:
Voor de dissociatie van zwak azijnzuur wordt de totale concentratie van het CH 3 COO – anion bepaald door de concentratie van ionen afkomstig van de dissociatie van het zout, die op zijn beurt gelijk is aan de concentratie van het zout (c s ), dat is natriumacetaat. Een hoge concentratie van deze anionen zorgt ervoor dat de concentratie van H + kationen afneemt en dientengevolge wordt de zuurdissociatiegraad verlaagd om de K a -waarde stabiel te houden. Vanwege deze relatie kunnen we ook aannemen dat het aantal niet-gedissocieerde CH3COOH – moleculen praktisch identiek is aan de totale concentratie azijnzuur ( ck ). Daarom kan de dissociatieconstante als volgt worden genoteerd: 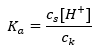 Nadat we de logaritme hebben genomen, verkrijgen we een relatie die leidt tot de Henderson-Hasselbach-vergelijking:
Nadat we de logaritme hebben genomen, verkrijgen we een relatie die leidt tot de Henderson-Hasselbach-vergelijking: 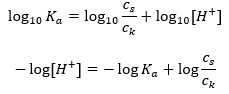 De Henderson-Hasselbach-vergelijking heeft dus de volgende vorm:
De Henderson-Hasselbach-vergelijking heeft dus de volgende vorm: 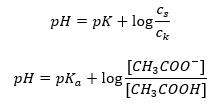 Om de relaties uit te schrijven, de pKa-waarde in de vergelijking is in feite de maat voor de sterkte van het zuur. Elke pKa-waarde lager dan 3 (-log(0,001)) is kenmerkend voor sterke zuren, terwijl hoe hoger de waarde, hoe zwakker het zuur. Het feit dat resulteert uit de Henderson-Hasselbach-vergelijking is de equivalentie van de pH-waarde van de bufferoplossing en de pKa van het zuur op het moment dat de verhouding van de concentratie van het niet-gedissocieerde zuur en de concentratie van het anion geproduceerd door de dissociatie van het zuur is gelijk aan 1, aangezien log(1) gelijk is aan 0. Dergelijke omstandigheden bestaan als resultaat van het titreren van een zwak zuur met een sterke base, als we een zodanige hoeveelheid van de base toevoegen dat overeenkomt met de helft van de hoeveelheid die nodig is voor de volledige neutralisatie van het zuur. Dan is de titratiegraad van de oplossing 50%. In de afhankelijkheid tussen de pH en het volume van de gebruikte titrant verandert de pH-waarde in het buffergebied relatief langzaam.
Om de relaties uit te schrijven, de pKa-waarde in de vergelijking is in feite de maat voor de sterkte van het zuur. Elke pKa-waarde lager dan 3 (-log(0,001)) is kenmerkend voor sterke zuren, terwijl hoe hoger de waarde, hoe zwakker het zuur. Het feit dat resulteert uit de Henderson-Hasselbach-vergelijking is de equivalentie van de pH-waarde van de bufferoplossing en de pKa van het zuur op het moment dat de verhouding van de concentratie van het niet-gedissocieerde zuur en de concentratie van het anion geproduceerd door de dissociatie van het zuur is gelijk aan 1, aangezien log(1) gelijk is aan 0. Dergelijke omstandigheden bestaan als resultaat van het titreren van een zwak zuur met een sterke base, als we een zodanige hoeveelheid van de base toevoegen dat overeenkomt met de helft van de hoeveelheid die nodig is voor de volledige neutralisatie van het zuur. Dan is de titratiegraad van de oplossing 50%. In de afhankelijkheid tussen de pH en het volume van de gebruikte titrant verandert de pH-waarde in het buffergebied relatief langzaam. 
Voorbeeld: ammoniumbuffer
Een ander type buffer is de ammoniumbuffer, een mengsel van een zwakke base (NH 4 OH) met een sterk zuur (NH 4 Cl). Het mechanisme lijkt echter sterk op elkaar. Het in het mengsel aanwezige zout ondergaat volledige dissociatie en de constante is de volgende vergelijking: 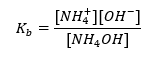 Terwijl de ammoniumbase praktisch niet-gedissocieerd is in de sterke elektrolyt (NH 4 Cl). Om deze reden nemen we aan dat de concentratie van het NH 4 + -kation gelijk is aan de concentratie van het zout, maar de concentratie van niet-gedissocieerde NH 4 OH-moleculen is identiek aan de concentratie van de base. Dit maakt het mogelijk om de vergelijking te formuleren en de pH van die buffer te berekenen.
Terwijl de ammoniumbase praktisch niet-gedissocieerd is in de sterke elektrolyt (NH 4 Cl). Om deze reden nemen we aan dat de concentratie van het NH 4 + -kation gelijk is aan de concentratie van het zout, maar de concentratie van niet-gedissocieerde NH 4 OH-moleculen is identiek aan de concentratie van de base. Dit maakt het mogelijk om de vergelijking te formuleren en de pH van die buffer te berekenen. 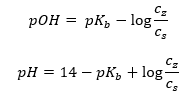 De NH 4 + en Cl – ionen, en NH 4 OH moleculen aanwezig in de ammoniumbuffer resulteren in het feit dat zodra we een zuur of base toevoegen, de volgende reacties optreden: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Als de toevoeging klein is, is de verandering in de base-zoutconcentratieverhouding, en dus de verandering van de pH, ook klein. Bij een tienvoudige verandering in de verhouding van deze concentraties verandert de pH-waarde met één eenheid.
De NH 4 + en Cl – ionen, en NH 4 OH moleculen aanwezig in de ammoniumbuffer resulteren in het feit dat zodra we een zuur of base toevoegen, de volgende reacties optreden: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Als de toevoeging klein is, is de verandering in de base-zoutconcentratieverhouding, en dus de verandering van de pH, ook klein. Bij een tienvoudige verandering in de verhouding van deze concentraties verandert de pH-waarde met één eenheid.
Buffer capaciteit
De term” buffercapaciteit” verwijst naar het vermogen van een bufferoplossing om een ongeveer constante zuurgraad van een oplossing te behouden. Nauwkeuriger gezegd, het is het aantal gram-equivalenten van een sterk zuur of sterke base dat, wanneer toegevoegd aan 1 dm3 van een bufferoplossing, de pH-waarde met één verandert. De formule die de buffercapaciteit (β) definieert, omvat de afhankelijkheid van het aantal molen van een sterk zuur/base na toevoeging aan de bufferoplossing (Δn, [ml]) en de verandering in de pH waargenomen tijdens het toevoegen van de volume van een sterk zuur of sterke base aan de bufferoplossing (ΔpH). ![]() Het is een waarde die sterk verband houdt met de concentraties van de ingrediënten, die stijgen naarmate ze toenemen. De hoogste waarde van de buffercapaciteit kenmerkt de bufferoplossingen waarvan de pH gelijk is aan de dissociatieconstante (pKa) van het zuur dat gebruikt is om ze te produceren.
Het is een waarde die sterk verband houdt met de concentraties van de ingrediënten, die stijgen naarmate ze toenemen. De hoogste waarde van de buffercapaciteit kenmerkt de bufferoplossingen waarvan de pH gelijk is aan de dissociatieconstante (pKa) van het zuur dat gebruikt is om ze te produceren.
Werkingsprincipe van een fosfaatbuffer
Een minder populair type buffers zijn die buffers die twee zure zouten bevatten. In dit geval zijn het twee zure zouten van het orthofosforzuur (V), dat wil zeggen monobasisch natriumfosfaat (V) en dibasisch natriumfosfaat (V). In tegenstelling tot de meest voorkomende buffers, die ook gebaseerd zijn op het Brønsted-principe van geconjugeerde zuur-baseparen, is de aard van de ingrediënten niet zo eenvoudig te bepalen. Aangezien de in de fosfaatbuffer aanwezige anionen waarden vertonen die karakteristiek zijn voor Brønsted-zuren, moeten we het verschil daartussen nauwkeuriger controleren. Volgens dat principe moet het ion, dat het sterkere zuur is, een hogere dissociatieconstante hebben.
- Voor H 2 PO 4 – K a = 6,34·10 -8
- Voor HPO 4 -2 K a = 4,36·10 -13
Als we over dergelijke gegevens beschikken, kunnen we gemakkelijk stellen dat in dit geval het H 2 PO 4 -13 waterstofanion het zwakke Brønsted-zuur is. Het werkingsmechanisme van de buffer is gebaseerd op een dynamisch evenwicht dat kan worden uitgedrukt door de volgende vergelijking: ![]() Als we kleine hoeveelheden zuur aan de bufferoplossing toevoegen, zal het systeem proberen de veranderingen in pH te voorkomen als gevolg van de reactie van het blokkeren van het effect van [H +] kationen door het waterstofanion te protoneren, volgens het volgende vergelijking:
Als we kleine hoeveelheden zuur aan de bufferoplossing toevoegen, zal het systeem proberen de veranderingen in pH te voorkomen als gevolg van de reactie van het blokkeren van het effect van [H +] kationen door het waterstofanion te protoneren, volgens het volgende vergelijking: ![]() Het feit dat het het anion is dat de aan de oplossing toegevoegde buffers neutraliseert, is een gevolg van het feit dat het dat anion is dat de sterkere Brønsted-base is. In dergelijke systemen passen we een regel toe die stelt dat hoe sterker het Brønsted-zuur is, hoe zwakker de geconjugeerde base. Als we een zuur toevoegen aan een systeem dat meerdere Brønsted-basen bevat, dan zal de sterkste base als eerste reageren. Deze relatie is de belangrijkste component bij het analyseren van de evenwichten die bestaan in mengsels van waterige bufferoplossingen bestaande uit een mengsel van Brønsted-zuren en een mengsel van zwakke Brønsted-basen. Dezelfde regel, maar dan in omgekeerde volgorde, is van toepassing als we een basische oplossing toevoegen aan een fosfaatbuffer. De OH – anionen zullen bijna onmiddellijk worden ingevangen door het sterkere Brønsted-zuur dat in de buffer aanwezig is. In dit geval is dit het ion en vindt de reactie plaats volgens de volgende vergelijking:
Het feit dat het het anion is dat de aan de oplossing toegevoegde buffers neutraliseert, is een gevolg van het feit dat het dat anion is dat de sterkere Brønsted-base is. In dergelijke systemen passen we een regel toe die stelt dat hoe sterker het Brønsted-zuur is, hoe zwakker de geconjugeerde base. Als we een zuur toevoegen aan een systeem dat meerdere Brønsted-basen bevat, dan zal de sterkste base als eerste reageren. Deze relatie is de belangrijkste component bij het analyseren van de evenwichten die bestaan in mengsels van waterige bufferoplossingen bestaande uit een mengsel van Brønsted-zuren en een mengsel van zwakke Brønsted-basen. Dezelfde regel, maar dan in omgekeerde volgorde, is van toepassing als we een basische oplossing toevoegen aan een fosfaatbuffer. De OH – anionen zullen bijna onmiddellijk worden ingevangen door het sterkere Brønsted-zuur dat in de buffer aanwezig is. In dit geval is dit het ion en vindt de reactie plaats volgens de volgende vergelijking: ![]()
Bekende buffers en hun toepassingen
- Bloed handhaaft de waarden van 7,35 en 7,45 eenheden, en de stabiliteit ervan wordt gegarandeerd door de aanwezigheid van koolzuur, voornamelijk in de vorm van opgelost kooldioxide en HCO 3- Het is een buffer die een zwak zuur en zijn zout is, en elke toevoeging van een overmatige hoeveelheid zuren of basen zal omstandigheden veroorzaken die gevaarlijk zijn voor het menselijk leven. Een soortgelijk voorbeeld van een buffer is speeksel, waarvan de pH rond de 7 ligt.
- Ammonium-, acetaat-, fosfaat- en boraatbuffers, dus respectievelijk:
- NH 3 + NH 4 Cl pH = 8 – 11;
- CH 3 COOH + CH 3 COONa pH 3,5 – 6;
- K 2 HPO 4 + KH 2 PO 4 pH = 5,5 – 8;
- H 3 BO 3 + Na 2 B 4 O 7 pH = 7 – 9.
Alle populaire buffers worden toegepast waar het essentieel is om de pH op een constant niveau te houden, dus bijvoorbeeld:
- in de geneeskunde, waar ze intraveneus worden toegediend aan patiënten in kritieke toestand;
- in microbiële culturen, waar de reactie van de bodem een belangrijke factor is;
- bij het werken met enzymen en eiwitten, om de omgeving voor chemische reacties te stabiliseren;
- bij galvaniseren, waar ze worden gebruikt voor elektrolytische baden, omdat ze snelle, kritieke veranderingen in hun pH in het gebied nabij de elektrode kunnen voorkomen;
- voor het kalibreren van pH-meters.
