Het is een van de oudste instrumentele methoden die worden gebruikt in chemische analyse. De fundamenten werden tussen de 18e en 19e eeuw gelegd door L. Galvani, CA Volta, JW Gibbs en W. Nernst. Metingen uitgevoerd met potentiometrische methoden gebruiken de elektromotorische kracht (EMF) van een cel die is opgebouwd uit twee elektroden die zijn ondergedompeld in de geteste oplossing. De waarde van die kracht hangt rechtstreeks af van de potentialen van de gebruikte elektroden. Deze zijn op hun beurt afhankelijk van de activiteit van de ionen in de elektrolytoplossing en van de aard van de elektrodeprocessen.
Diagram van elektrodeprocessen geïllustreerd door de Daniell-cel
De Daniell-cel bestaat uit twee halve cellen, elk samengesteld uit een metaal ondergedompeld in de oplossing van zijn eigen zout. De samenstellende halfcellen zijn de systemen van Cu (s) /Cu 2+ (aq) en Zn (s) /Zn 2+ (aq) . Elk van hen ondergaat een van de volgende redoxreacties:
- afname
Cu 2+ (aq) + 2e – → Cu (s)
- oxidatie
Zn (s) → Zn 2+ (aq) + 2e – Als we beide reacties combineren, krijgen we de volledige vergelijking voor de reactie die in de cel plaatsvindt: Zn (s) + Cu 2+ (aq) + 2e – → Zn 2 + (aq) + 2e – + Cu (s) Om een bepaalde elektromotorische kracht van de cel te meten, moeten we de halfcellen met elkaar verbinden door middel van een zoutbrug en de elektroden verbinden met een voltmeter . Zo kunnen we het potentiaalverschil tussen individuele elektroden meten, wat de EMF-waarde van de cel vertegenwoordigt . Volgens de IUPAC-conventie ziet het diagram van de Daniell-cel er als volgt uit: ϴ Zn|Zn 2+ ||Cu 2+ |Cu ⊕ De enkele lijnen staan voor de interface en de dubbele lijnen stellen de zoutbrug voor. Het potentiaal op het grensvlak is een resultaat van de oxidatie- en reductiereacties. Voor de cellen gaan we ervan uit dat de elektrode waar oxidatie plaatsvindt de anode is met het ϴ-teken, terwijl de andere een positieve kathode is waar reductie plaatsvindt . De notatie begint met de anode en de kathode wordt aan de rechterkant genoteerd . De elektromotorische kracht van zo’n cel kan worden berekend aan de hand van de volgende formule: EMF = kathodepotentiaal – anodepotentiaal
Standaard elektrodepotentiaal
Deze term is geïntroduceerd voor systematisering en een bepaalde potentiaal van een elektrode wordt als "standaard" beschouwd als deze aan een aantal voorwaarden voldoet. De meting moet worden uitgevoerd bij 298 K, de activiteit van actieve ionen moet gelijk zijn aan 1 mol/dm 3 , en de referentie-elektrode moet een standaard waterstofelektrode zijn, aangezien wordt aangenomen dat de potentiaal van die elektrode 0,0000 V is.
Elektromotorische kracht van de cel
De EMF-waarde verandert mee met de veranderende activiteit van de in de cel aanwezige ionen. De vergelijking die deze relatie weergeeft, wordt de Nernst-vergelijking genoemd: 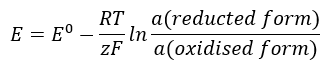 Het gebruikt de volgende symbolen: elektrodepotentiaal (E), standaard elektrodepotentiaal (E 0 ), gasconstante (R) gelijk aan 8,312 J/K·mol, temperatuur (T), het aantal elektronen dat betrokken is bij de elektrochemische reactie van elektronen (z), Faraday-constante (F) gelijk aan 9,64853·10 4 C/mol, en de activiteit van ionen in de gereduceerde en geoxideerde vorm. Voor vaste stoffen wordt aangenomen dat de activiteit (a) 1 is.
Het gebruikt de volgende symbolen: elektrodepotentiaal (E), standaard elektrodepotentiaal (E 0 ), gasconstante (R) gelijk aan 8,312 J/K·mol, temperatuur (T), het aantal elektronen dat betrokken is bij de elektrochemische reactie van elektronen (z), Faraday-constante (F) gelijk aan 9,64853·10 4 C/mol, en de activiteit van ionen in de gereduceerde en geoxideerde vorm. Voor vaste stoffen wordt aangenomen dat de activiteit (a) 1 is. 
Potentiometrische instrumentatie
De basisset voor potentiometrische metingen bestaat uit twee componenten: een paar elektroden ondergedompeld in de geteste oplossing en een meetapparaat . De eerste component is de meetcel , terwijl de tweede de daadwerkelijke meting van de elektromotorische kracht mogelijk maakt. Het belangrijkste onderdeel van een cel zijn de elektroden. Volgens hun werkingsmechanisme kunnen ze in vier groepen worden ingedeeld.
Zoutbrug
Een belangrijk element van elke cel is de zoutbrug, waardoor de referentie-elektrode contact kan maken met de geteste oplossing . Het fundamentele kenmerk van een cel met overdracht is het contact tussen elektrolyten met verschillende concentraties en samenstellingen. Om vermenging van de elektrolyt van de brug met de geteste oplossing te voorkomen, worden kleine contactoppervlakken gebruikt.
Elektroden van de eerste soort
Deze elektroden zijn gemaakt van een metaal of gas ondergedompeld in de oplossing die hun eigen ionen bevat . Ze worden ook elektroden genoemd die reversibel zijn met het kation , omdat op hun oppervlak de volgende reversibele reactie plaatsvindt: M 0 ↔ M n+ + ne Een voorbeeld van elektroden van de eerste soort is de waterstofelektrode.
Elektroden van de tweede soort
Dergelijke elektroden zijn gemaakt van een metaal bedekt met zijn matig oplosbare zout . Het systeem wordt ondergedompeld in een vrij oplosbaar zout, dat hetzelfde anion bevat als het slecht oplosbare zout. Deze elektroden worden elektroden genoemd die reversibel zijn met het gemeenschappelijke anion , omdat op hun oppervlak de volgende reactie plaatsvindt: M 0 + A – ↔ MA + e Voorbeelden van elektroden van de tweede soort zijn de zilver-zilverchloride- of calomel-elektroden.
Elektroden van de derde soort
Deze zijn samengesteld uit metalen omgeven door twee lagen: de eerste, dunne laag gemaakt van een slecht oplosbaar zout van dat metaal, en de tweede laag gemaakt van een iets beter oplosbaar zout dat hetzelfde anion bevat. Het zijn elektroden die omkeerbaar zijn tot gemeenschappelijk kation , aangezien op hun oppervlak de volgende reactie plaatsvindt: M 0 (a) + M (b) A ↔ M (a) A + M + (b) + e 
Redox-elektroden
De structuur van dergelijke elektroden wordt gekenmerkt door het gebruik van een chemisch inert metaal, bijvoorbeeld platina of goud, dat wordt ondergedompeld in een oplossing die een stof in zowel gereduceerde als geoxideerde vorm bevat. Een voorbeeld van dergelijke elektroden is de quinhydron-elektrode.
Functies van elektroden in een systeem
Qua toepassing in een analytisch systeem onderscheiden we:
- referentie-elektroden , die een constant potentiaal behouden, ongeacht de meetomstandigheden of de concentratie van de geteste oplossing.
- indicatorelektroden , waarvan het potentiaal verandert als de geteste oplossing ionen bevat, waarvoor ze gevoelig zijn.
Referentie-elektroden
Potentiometrische meting is gebaseerd op de vergelijking van de potentiaal van de indicatorelektrode met de referentie-elektrode . Om deze reden moeten dergelijke elektroden worden gekenmerkt door:
- stabiel potentieel,
- reproduceerbare potentiaal- en temperatuuronafhankelijkheid,
- veelzijdigheid en gebruiksgemak,
- lage elektrische weerstand,
- reproduceerbaar en laag diffusiepotentieel,
- weinig stroom van de elektrolyt van de elektrode naar de geteste oplossing.
Een veelgebruikte referentie-elektrode is de zilver-zilverchloride-elektrode (Ag/AgCl/KCl), die reageert op de aanwezigheid van chloride-ionen. Het is gemaakt van een zilverdraad bedekt met een laagje zilverchloride. Een ander voorbeeld is de calomel-elektrode (Pt/Hg/Hg 2 Cl 2 /KCl), waarvan de potentiaal mede afhangt van de activiteit in een chloride-ionoplossing.
Indicator elektroden
Voor de elektroden uit deze categorie verandert hun potentiaal in aanwezigheid van geteste ionen in de oplossing . Dit betekent dat hun potentieel direct afhangt van de activiteit, dus ook de concentratie, van de oplossing waarin ze zijn geplaatst . De meest gebruikte elektroden zijn ondergedompeld in de oplossingen van hun eigen ionen, zoals zilver-, kwik- of waterstofelektroden. In moderne potentiometrie worden echter ionselectieve membraanelektroden gebruikt. Ze hebben een aantal gemeenschappelijke kenmerken, hun actieve deel is bijvoorbeeld het membraan en de ionische reactie tussen de ionen uit de oplossing en het membraan bepaalt het verschil in potentiaal op hun grensvlak. Dergelijke elektroden kunnen op basis van hun structuur worden onderverdeeld in elektroden van glas, vaste membraan, vloeistofmembraan en dubbele membraanelektroden. De meest gebruikte zijn de glaselektroden, die zijn opgebouwd uit een glazen buis die eindigt met een dunwandige bol van elektrodeglas. Het herbergt de interne zilver-zilverchloride-elektrode ondergedompeld in de interne oplossing met een constante activiteit van ionen.
























































































































