Spectroscopische methoden zijn een groep methoden waarbij een signaal wordt geproduceerd door de interactie van elektromagnetische of corpusculaire straling met het onderzochte monster. Deze straling kan ontstaan als gevolg van periodieke veranderingen in het elektromagnetische veld die verband houden met energieoverdracht. Deze methoden worden gebruikt om de concentratie of het gehalte aan atomen in een bepaald absorberend of emitterend systeem te bepalen. Welke soorten spectrofotometrie zijn er en wat houden deze methoden in? Dit is wat u uit ons artikel zult ontdekken.

Straling en energietransities
De belangrijkste eigenschap van fotonen, of stralingskwanta, is energie. De formule voor de energiewaarde (E) is het product van de constante van Planck (h) van 6,626·10 -34 [J ·s] en de stralingsfrequentie (v) uitgedrukt in Hertz [Hz]. 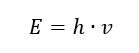 Spectrofotometrie maakt gebruik van energietransities in moleculen, veroorzaakt door de absorptie of emissie van elektromagnetische straling in verschillende bereiken:
Spectrofotometrie maakt gebruik van energietransities in moleculen, veroorzaakt door de absorptie of emissie van elektromagnetische straling in verschillende bereiken:
- ultraviolet (UV) 200-380 nm,
- zichtbare straling (Vis) 380-780 nm,
- nabij-infrarood (IR) 0,78-30.000 μm.
Basisconcepten en wetten van spectrofotometrie
Isosbestisch punt
Dit is het punt dat overeenkomt met een specifieke golflengte die voortkomt uit het snijpunt van curven die zijn uitgezet in het absorptie-golflengtesysteem, waarbij beide vormen van de verbinding in oplossing (gedissocieerd en niet-gedissocieerd) gelijke absorptie hebben. Een verandering in de pH verandert de positie niet; een verbinding kan veel van dergelijke punten hebben.
Absorptiespectrum van een chemische verbinding
Het spectrum is een maat voor de hoeveelheid licht die door de verbinding wordt geabsorbeerd vanaf de lichtgolflengte (λ). Als elektromagnetische straling (licht) met een intensiteit I 0 op een monster valt, zal een deel van deze straling worden geabsorbeerd en een deel door het monster gaan. Door de intensiteiten van invallende (I 0 ) en doorgelaten (I t ) straling vast te leggen, kunnen we de hoeveelheid licht bepalen die door de oplossing wordt geabsorbeerd (absorptie, A), of er doorheen is gegaan (transmissie, T).
Absorptie
De grootheid die het fenomeen absorptie beschrijft, is absorptie. Dit is een dimensieloze maatstaf voor de intensiteit van elektromagnetische straling in verhouding tot het aantal vrije atomen. Dit cijfer is ingevoerd om berekeningen met betrekking tot absorptievolumes te vergemakkelijken. Absorptie is de interactie tussen elektromagnetische straling en materie – de absorptie van een deel van de energie door materie. De absorptie is additief en wordt soms optische dichtheid genoemd. Symbolisch wordt dit geregistreerd als Abs of A. Wiskundig gezien is dit de decimale logaritme van de verhouding tussen de intensiteit van de stralingsbundel die op het testmonster valt (I 0 ) en de intensiteit van de stralingsbundel die door het testmonster wordt doorgelaten. ( Het ). Het kan waarden aannemen van 0 tot oneindig. De wiskundige uitdrukking die deze relatie beschrijft, wordt de wet van Beer-Lambert genoemd. De absorptie bij een bepaalde golflengte hangt af van de absorptiecoëfficiënt (ε), de dikte van de absorberende laag (meestal 1 cm) en de concentratie van de testoplossing.
Doorlaatbaarheid
De transmissie is de verhouding tussen de bestralingssterkte die door het monster gaat ( It ) en de bestralingssterkte die op het monster valt ( Io ), wat gelijk is aan de bestralingssterkte die door de referentie gaat. Het wordt meestal uitgedrukt als een percentage en kan variëren van 0%tot 100%. Het wordt uitgedrukt door de formule: 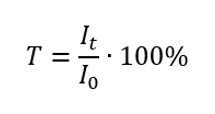 De relatie tussen absorptie en transmissie wordt als volgt uitgedrukt:
De relatie tussen absorptie en transmissie wordt als volgt uitgedrukt: 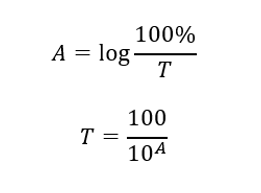
Lambertus Wet
Er staat dat de absorptie evenredig is met de dikte van de absorberende laag van een homogeen monster. Het kan worden geregistreerd als het quotiënt van de absorptiecoëfficiënt (k) en de dikte van de gemeten monsterlaag (l): 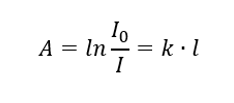

Wet van Beer-Lambert
Het betreft de absorptie van straling door oplossingen en kan als volgt worden geformuleerd: als de absorptiecoëfficiënt van het oplosmiddel nul is, dan is de absorptie van een monochromatische stralingsbundel die door een homogene oplossing gaat recht evenredig met de concentratie (c) van de oplossing en op de dikte van de absorberende laag (l). De wet van Beer-Lambert is de definitie van absorptie en kan als volgt worden geschreven: 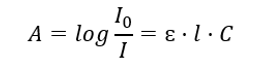 De molaire absorptiecoëfficiënt (ɛ) is een karakteristieke waarde van een stof in een bepaald oplosmiddel en bij een bepaalde golflengte. Het is evenredig met de waarschijnlijkheid van overgangen tussen de energieniveaus van het molecuul en hangt rechtstreeks af van de energie van de stralingsfotonen. In numerieke termen vertegenwoordigt dit de absorptie die wordt vertoond door een oplossing met een concentratie van 1 mol/ dm3 , met een absorberende laagdikte van 1 cm. Het kennen van de coëfficiënt maakt het mogelijk om de concentratie van de testoplossing te bepalen na het meten van de grootte van de absorptie. Optioneel kan de verwachte absorptie van de oplossing ook worden berekend op basis van de coëfficiënt en de concentratie. De formule wordt voornamelijk gebruikt om de concentratie te bepalen van een stof met een bekende molaire absorptiecoëfficiënt en empirisch gemeten absorptie. Dit kan worden gedaan met behulp van een formule of door een ijkcurve voor de stof te tekenen op verschillende punten in het bereik van de verwachte concentratie. De wet van Beer-Lambert kan ook worden gepresenteerd als concentratie-afhankelijkheid van absorptie: A = f(C).
De molaire absorptiecoëfficiënt (ɛ) is een karakteristieke waarde van een stof in een bepaald oplosmiddel en bij een bepaalde golflengte. Het is evenredig met de waarschijnlijkheid van overgangen tussen de energieniveaus van het molecuul en hangt rechtstreeks af van de energie van de stralingsfotonen. In numerieke termen vertegenwoordigt dit de absorptie die wordt vertoond door een oplossing met een concentratie van 1 mol/ dm3 , met een absorberende laagdikte van 1 cm. Het kennen van de coëfficiënt maakt het mogelijk om de concentratie van de testoplossing te bepalen na het meten van de grootte van de absorptie. Optioneel kan de verwachte absorptie van de oplossing ook worden berekend op basis van de coëfficiënt en de concentratie. De formule wordt voornamelijk gebruikt om de concentratie te bepalen van een stof met een bekende molaire absorptiecoëfficiënt en empirisch gemeten absorptie. Dit kan worden gedaan met behulp van een formule of door een ijkcurve voor de stof te tekenen op verschillende punten in het bereik van de verwachte concentratie. De wet van Beer-Lambert kan ook worden gepresenteerd als concentratie-afhankelijkheid van absorptie: A = f(C).
Wet van de additiviteit
De wet van Beer-Lambert verwijst naar het geval waarin er één absorberende stof in oplossing is. Als er echter meer stoffen in een uit meerdere componenten bestaande oplossing zitten die straling op een geselecteerde golflengte absorberen, is de absorptie van deze oplossing (A) gelijk aan de som van de absorpties van de afzonderlijke componenten (A 1 , A 2 ,…), dat wil zeggen A=A 1 +A 2 +⋯+Een n . Het is de moeite waard om op te merken en te onthouden dat de absorptie van elke component het product is van zijn concentratie en de overeenkomstige molaire absorptiecoëfficiënt. Dit is de derde absorptiewet, die wordt gebruikt bij spectrofotometrische analyse van systemen met meerdere componenten.
Afwijkingen van de wetten van absorptie
Een voorwaarde om aan de absorptiewetten te voldoen is dat de straling die op het systeem inwerkt monochromatisch is en dat de intensiteit ervan niet te hoog is. De redenen om af te wijken van de Beer-Lambert-wet kunnen zijn:
- onvolkomenheid van meetinstrumenten, waardoor niet aan de voorwaarde wordt voldaan,
- chemische reacties die optreden tijdens de meting, bijvoorbeeld polymerisatie , hydrolyse, condensatie,
- troebelheid van de oplossing.
Toepassing van elektronenabsorptiespectra
- Hiermee kan het type elektronenovergangen worden bepaald door spectra in oplosmiddelen met verschillende polariteit te onderzoeken.
- De verschillen in de positie en intensiteit van de absorptiebanden van de verschillende moleculaire vormen worden gebruikt om de evenwichten tussen hen in de oplossing te bestuderen ( structuurstudies , tautomere evenwichten).
- Wordt gebruikt voor de bepaling van verbindingen op basis van de wet van Beer-Lamber.
- Gebruikt als aanvullende identificatiemethode op basis van de λmax – positie van teststoffen.
- Gebruikt bij het bepalen van de zuiverheid van testverbindingen – het verschuiven van de maximale absorptiepositie, het vergelijken van de verhouding van absorptiewaarden op twee verschillende punten in het spectrum.

UV-Vis-elektronenspectroscopie
Wat het fenomeen absorptie betreft, is UV-Vis-spectrofotometrie een bijzonder interessante techniek, die kwalitatieve en kwantitatieve analyse van veel stoffen mogelijk maakt. Het fenomeen stralingsabsorptie wordt gebruikt wanneer: de absorptie lineair afhangt van de concentratie of wanneer de absorptie additief is, dwz voor een oplossing met meerdere componenten is deze de som van de absorpties van zijn componenten. Aan de voorwaarden wordt voldaan als er geen intermoleculaire interacties in het systeem plaatsvinden. Door de UV-Vis-absorptiespectra te analyseren die het gevolg zijn van de passage van elektromagnetische straling door de oplossing, worden overgangen van valentie-elektronen van de grond naar de aangeslagen toestand waargenomen. Dit fenomeen resulteert in de absorptie van een deel van de straling bij bepaalde golflengten. Absorptie is het gevolg van de overgang van deze elektronen naar hogere energieniveaus, maar om dit te laten gebeuren moeten de kwanta van elektromagnetische straling voldoende energie hebben om het energieverschil tussen de energieniveaus in evenwicht te brengen. In moleculen bedragen dergelijke energieën enkele elektronvolts, wat precies overeenkomt met de UV-Vis-frequentie.
Chromoforen
Verbindingen die absorptie in het UV-Vis-bereik vertonen, hebben chromoforen in hun structuur, dat wil zeggen groepen atomen waarvan de elektronen worden gekenmerkt door lage excitatie-energieën. Met andere woorden: een chromofoor is het deel van een molecuul (groep atomen) dat verantwoordelijk is voor de selectieve absorptie van straling in het zichtbare bereik (180-800 nm) en dus voor het optreden van kleur. Deze omvatten: aromatische ringen (aromatisch elektronensextet), meerdere bindingen (een deel daarvan – π-type bindingen), zowel tussen koolstofatomen als andere, zoals de carbonylgroep C=O.
Auxochromen
Een andere groep atomen zijn de auxochromen, dwz substituenten die geen absorptie vertonen in het UV-Vis-bereik, maar hun aanwezigheid veroorzaakt veranderingen in de spectra van de absorberende elementen. Ze versterken de werking van de chromoforen, wat we vaak kunnen waarnemen in de vorm van een veel intensere kleuring van de teststof dan wanneer ze niet in het systeem aanwezig zijn. Daarnaast verdelen we de auxochromen in bathochromen , bijvoorbeeld –NH 2 , -OH, die het absorptiemaximum naar langere golflengten verschuiven, en hypsochromen , zoals –CH 3 , -CO, die het maximum naar kortere golflengten verschuiven.
Atoomabsorptiespectroscopie (AAS)
Dit is een andere techniek die gebruik maakt van het fenomeen absorptie. Het wordt gebruikt om chemische elementen te bepalen in de vorm van monsters in welke staat dan ook (vloeistof, vast, gas) en de meting zelf is gebaseerd op het waarnemen van de absorptie van straling van een specifieke golflengte door vrije metaalatomen. De basis van de techniek is dat een atoom alleen elektromagnetische straling kan absorberen op een golflengte waarbij het deze ook kan uitzenden, en dit is alleen kenmerkend voor het gegeven element. Wanneer er hogere energie aan het atoom wordt geleverd, worden de elektronen naar hogere niveaus geëxciteerd en wordt een groter aantal lijnen in het spectrum waargenomen. Als de geleverde energie overeenkomt met het ionisatiepotentieel van het atoom, worden ionen zoals Na + gevormd. De basis voor kwantitatieve analyse door atomaire absorptiespectrometrie is de evenredigheid van de absorptie met het aantal absorberende atomen en de wet van Beer-Lambert.
