Stoichiometrie is de tak van de algemene scheikunde die zich bezighoudt met berekeningen met betrekking tot het kwantitatieve verloop van chemische reacties. Wanneer we in het laboratorium werken, is het heel vaak nodig om te weten hoeveel (massa, volume, moleculen) van de substraten we nodig hebben om de chemische reactie die we uitvoeren volledig te laten plaatsvinden of om de hoeveelheid product te verkrijgen wij willen. Soms is het ook nodig om overtollig of ontbrekend substraat te berekenen waardoor het experiment anders verliep dan verwacht. Elk van deze berekeningen volgt rechtstreeks uit de kwantitatieve interpretatie van de chemische reactievergelijking en maakt gebruik van de wetten van behoud van massa. Dit soort vergelijkingen worden stoichiometrische berekeningen genoemd.

Wat moeten we weten?
Om stoichiometrie te kunnen gebruiken, hebben we kennis nodig op een aantal gebieden, waaronder: chemische reactievergelijkingen, stoichiometrische coëfficiënten, molaire en molaire massa’s en molaire volumes van gassen en de wet van Avogadro . Met behulp van kennis van de stoichiometrie van chemische reacties kunnen veel rekenproblemen worden opgelost, zoals:
- elementaire analyse,
- molaire berekeningen,
- massaberekeningen,
- berekening van niet-stoichiometrische mengsels met de mogelijkheid om de beperkende stof in de reactie te bepalen,
- reactie opbrengst.
Molaire massa
Vanwege de onvoorstelbaar kleine massa van individuele atomen en moleculen, ontstond de eenheid (u) , die de atomaire massa uitdrukt. In de praktijk is dit een waarde gelijk aan 1/12 van de massa van de koolstofisotoop 12 C. Dit deel van een stof hangt nauw samen met de constante t van Avogadro en wordt bepaald als het aantal grammen van een stof die 6,022·10 bevat. 23 atomen, moleculen of ionen. De molaire massa [M] is numeriek gelijk aan de atomaire of moleculaire massa en de eenheid is g/mol.
Molair volume van de stof [Vm]
Dit is een stofspecifieke waarde die sterk afhankelijk is van temperatuur- en drukomstandigheden. Dit is het volume van de stof dat wordt ingenomen door één mol ervan. Onder normale omstandigheden wordt een constante waarde van 22,4 dm 3 aangehouden.
Wet van constante samenstelling en behoud van massa
Elke chemische verbinding, ongeacht de oorsprong ervan en de wijze waarop deze wordt verkregen, heeft een goed gedefinieerde en constante kwalitatieve en kwantitatieve samenstelling. Zwavel (IV)oxide bevat bijvoorbeeld altijd 50 gew.%zwavel en zwavel (VI)oxide 40 gew.%van dit element. In een gesloten systeem is de massa van de resulterende producten gelijk aan de massa van de substraten die tijdens de reactie worden verbruikt. De wet van behoud van massa wordt weerspiegeld in de noodzaak om elke chemische reactievergelijking in evenwicht te brengen met de juiste chemische coëfficiënten, zodat de twee kanten van de vergelijking gelijk zijn in termen van het aantal aanwezige atomen. Stoichiometrische verhoudingen weerspiegelen de molaire verhoudingen van de reactanten die aanwezig zijn in de chemische reactie.
Chemische reactievergelijking
Alle benodigde informatie over de relatieve relaties tussen chemische stoffen is afgeleid van hun chemische reactievergelijking. Het biedt belangrijke relatieve en kwantitatieve informatie.
Voorbeeld 1.
Uit de vergelijking voor de synthese van ammoniak , die de reactie volgt: ![]() we kunnen verschillende interpretaties uitvoeren: moleculair, molair, molaire massa’s, molaire volumes en moleculaire getallen. a) Moleculair gezien kunnen we lezen dat drie moleculen waterstof reageren met één molecuul stikstof om twee moleculen ammoniak te vormen. b) Dit betekent ook dat drie mol waterstof reageert met één mol stikstof en het product vormt van twee mol ammoniak. c) Met behulp van het periodiek systeem van chemische elementen , dat de molmassa’s van de individuele atomen bevat, kunnen we uit de vergelijking ook concluderen dat 6 g waterstof volledig heeft gereageerd met 28 g stikstof om 34 g ammoniak te vormen. d) Dan weten we, uitgaande van normale omstandigheden, dat één mol gas 22,4 dm 3 in beslag neemt. Hieruit kunnen we concluderen dat 67,2 dm 3 waterstof reageert met 22,4 dm 3 stikstof en 44,8 dm 3 ammoniak vormt. e) Een andere bruikbare relatie is de wet van Avogadro, die stelt dat gelijke volumes van verschillende gassen hetzelfde aantal deeltjes bevatten onder dezelfde omstandigheden van druk en temperatuur. Als we de constante van Avogadro van 6,022·10 23 kennen , weten we dat we 3·6.022·10 23 waterstofmoleculen en 6,022·10 23 stikstofmoleculen nodig hebben om de volledige chemische reactie voor de synthese van ammoniak uit te voeren. De reactie levert 2.6.022.10 23 ammoniakmoleculen op.
we kunnen verschillende interpretaties uitvoeren: moleculair, molair, molaire massa’s, molaire volumes en moleculaire getallen. a) Moleculair gezien kunnen we lezen dat drie moleculen waterstof reageren met één molecuul stikstof om twee moleculen ammoniak te vormen. b) Dit betekent ook dat drie mol waterstof reageert met één mol stikstof en het product vormt van twee mol ammoniak. c) Met behulp van het periodiek systeem van chemische elementen , dat de molmassa’s van de individuele atomen bevat, kunnen we uit de vergelijking ook concluderen dat 6 g waterstof volledig heeft gereageerd met 28 g stikstof om 34 g ammoniak te vormen. d) Dan weten we, uitgaande van normale omstandigheden, dat één mol gas 22,4 dm 3 in beslag neemt. Hieruit kunnen we concluderen dat 67,2 dm 3 waterstof reageert met 22,4 dm 3 stikstof en 44,8 dm 3 ammoniak vormt. e) Een andere bruikbare relatie is de wet van Avogadro, die stelt dat gelijke volumes van verschillende gassen hetzelfde aantal deeltjes bevatten onder dezelfde omstandigheden van druk en temperatuur. Als we de constante van Avogadro van 6,022·10 23 kennen , weten we dat we 3·6.022·10 23 waterstofmoleculen en 6,022·10 23 stikstofmoleculen nodig hebben om de volledige chemische reactie voor de synthese van ammoniak uit te voeren. De reactie levert 2.6.022.10 23 ammoniakmoleculen op.
Voorbeeld 2.
De verbrandingsreactie van magnesium in chloor vindt plaats volgens de vergelijking: ![]() stelt ons in staat tot interpretaties te komen die vergelijkbaar zijn met het vorige voorbeeld. a) Zelfs op het eerste gezicht laat de gepresenteerde vergelijking ons toe te concluderen dat we, om één molecuul magnesiumchloride te verkrijgen, één molecuul magnesium en één molecuul chloor als substraten moeten leveren. b) Dit komt uiteraard overeen met het aantal mol dat in het systeem aanwezig is, dwz één mol magnesium, één mol chloor, één mol magnesiumchloride. c) Voor massaberekeningen weten we dat 24 g magnesium reageert met 71 g chloor en zo 95 g magnesiumchloride vormt. d) Omdat er bij de beschouwde chemische reactie slechts één gas, chloor , betrokken is, kunnen we er ook voor schrijven dat dit een volume van 22,4 dm 3 in beslag neemt. e) Bij deeltjestellingen is elke component gelijk aan de andere en heeft de waarde 6,022·10 23 .
stelt ons in staat tot interpretaties te komen die vergelijkbaar zijn met het vorige voorbeeld. a) Zelfs op het eerste gezicht laat de gepresenteerde vergelijking ons toe te concluderen dat we, om één molecuul magnesiumchloride te verkrijgen, één molecuul magnesium en één molecuul chloor als substraten moeten leveren. b) Dit komt uiteraard overeen met het aantal mol dat in het systeem aanwezig is, dwz één mol magnesium, één mol chloor, één mol magnesiumchloride. c) Voor massaberekeningen weten we dat 24 g magnesium reageert met 71 g chloor en zo 95 g magnesiumchloride vormt. d) Omdat er bij de beschouwde chemische reactie slechts één gas, chloor , betrokken is, kunnen we er ook voor schrijven dat dit een volume van 22,4 dm 3 in beslag neemt. e) Bij deeltjestellingen is elke component gelijk aan de andere en heeft de waarde 6,022·10 23 . 
Percentage opbrengst van chemische reactie [%W]
Stoichiometrische berekeningen worden ook gebruikt om de opbrengst van een reactie te achterhalen, dat wil zeggen de verhouding tussen de werkelijke hoeveelheid verkregen product en de hoeveelheid afgeleid uit de chemische reactievergelijking.
Voorbeeld 1.
De oxidatiereactie van 30 kg zwavel(IV)oxide werd uitgevoerd en in aanwezigheid van een platinakatalysator was het verkregen product 34 kg zwavel(VI)oxide. Wat was de opbrengst van dit proces? Chemische reactievergelijking: ![]() Uit de geregistreerde reactie kunnen we opmaken dat twee mol zwavel(IV)oxide dezelfde hoeveelheid mol zwavel(VI)oxide produceert. Als we de molmassa’s van de reactanten kennen, weten we dat stoichiometrisch, uitgaande van een opbrengst van 100%, 128 g SO 2 160 g SO 3 produceert. Met deze kennis kunnen we de verhouding bepalen: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 Vanaf hier gaan we uitzoeken hoeveel zwavel(VI)oxide er bij 100 procent geproduceerd zou worden opbrengst.
Uit de geregistreerde reactie kunnen we opmaken dat twee mol zwavel(IV)oxide dezelfde hoeveelheid mol zwavel(VI)oxide produceert. Als we de molmassa’s van de reactanten kennen, weten we dat stoichiometrisch, uitgaande van een opbrengst van 100%, 128 g SO 2 160 g SO 3 produceert. Met deze kennis kunnen we de verhouding bepalen: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 Vanaf hier gaan we uitzoeken hoeveel zwavel(VI)oxide er bij 100 procent geproduceerd zou worden opbrengst. 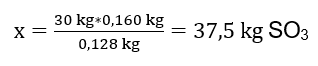 Als we de theoretische en werkelijke hoeveelheid SO 3 kennen, kunnen we de opbrengst berekenen waarbij de reactie plaatsvond. 37,5 kg SO 3 – 100%opbrengst 34 kg SO 3 – x%opbrengst
Als we de theoretische en werkelijke hoeveelheid SO 3 kennen, kunnen we de opbrengst berekenen waarbij de reactie plaatsvond. 37,5 kg SO 3 – 100%opbrengst 34 kg SO 3 – x%opbrengst 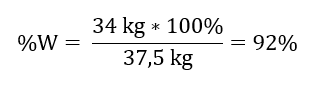 De oxidatie van zwavel(IV)oxide tot zwavel(VI)oxide met behulp van een platinakatalysator vond plaats met een opbrengst van 92%.
De oxidatie van zwavel(IV)oxide tot zwavel(VI)oxide met behulp van een platinakatalysator vond plaats met een opbrengst van 92%.
Moleculaire en elementaire formules
Een andere toepassing van stoichiometrische berekeningen is het bepalen van de formules van eenvoudige chemische verbindingen. De molecuulformule van een chemische verbinding is identiek aan, of een geheel veelvoud van, de empirische formule. Als we weten dat de algemene formule van een chemische verbinding N x O y is, kunnen de waarden van de stoichiometrische indices worden berekend door de massa per atomen te delen door hun atoommassa. Als het molecuulgewicht van een chemische verbinding niet bekend is, maar alleen de procentuele samenstelling ervan, kan alleen de elementaire formule worden gegeven. Het kan een waarheidsgetrouwe weergave zijn van de molecuulformule of alleen de verhouding van de afzonderlijke elementen bepalen.
Voorbeeld 1.
Het molecuulgewicht van de chemische verbinding is 92 u en bestaat uit 30,43 %stikstof en 69,57%zuurstof. Wat is de molecuulformule van de chemische verbinding? Omdat de som van de in de verbinding aanwezige moleculen 100%is, kunnen we aannemen dat: 92 u – 100%Dit stelt ons in staat de individuele elementaire inhoud te berekenen: 92 u – 100%xu stikstof – 30,43%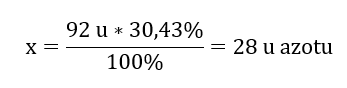 Daarom weten we dat de massa per zuurstofatoom is: 92 u – 28 u = 64 u Als we de individuele massa’s van de elementen kennen, kunnen we de stoichiometrische indices bepalen:
Daarom weten we dat de massa per zuurstofatoom is: 92 u – 28 u = 64 u Als we de individuele massa’s van de elementen kennen, kunnen we de stoichiometrische indices bepalen: 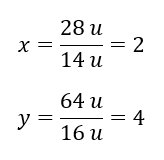 De molecuulformule van deze chemische verbinding is N 2 O 4 .
De molecuulformule van deze chemische verbinding is N 2 O 4 .
Voorbeeld 2.
Er zijn twee elementen in de chemische verbinding: zuurstof met 60%en 40%zwavel. Wat is de elementaire formule? De algemene formule is S x O y , waarbij x 40%is en y 60%. Als u de molmassa’s van de afzonderlijke elementen kent, kan dit als volgt worden weergegeven: 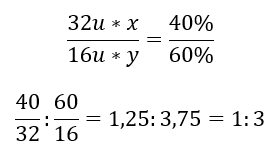 Dit betekent dat er in de gegeven chemische verbinding drie zuurstofatomen zijn voor elk zwavelatoom. De elementaire formule is SO 3 .
Dit betekent dat er in de gegeven chemische verbinding drie zuurstofatomen zijn voor elk zwavelatoom. De elementaire formule is SO 3 . 
Overtollig en beperkend substraat
In het geval van reacties waarin de reactanten aanwezig zijn in verhoudingen die afwijken van hun overeenkomstige stoichiometrie, zal een van de reactanten volledig reageren en zal de reactie stoppen. Het is dan aanwezig in de vorm van de beperkende reactant, terwijl de tweede reactant in overmaat in het systeem aanwezig zal zijn en ook nog steeds in zijn primaire vorm in het systeem aanwezig zal zijn wanneer de reactie voltooid is.
Voorbeeld 1.
In het laboratorium liet men 40 cm3 van een 0,25 M aluminiumsulfaatoplossing reageren met 50 cm3 van een 0,5 M bariumchlorideoplossing. Hoeveel gram neerslag zal er gevormd worden? Chemische reactievergelijking: ![]() De eerste stap om het werkelijke verloop van een reactie te kennen, is het bepalen van het werkelijke aantal mol van de stoffen die bij de reactie betrokken zijn. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol De tweede stap is om het tekort aan substraat te bepalen op basis van de stoichiometrie van de reactie – dit zal de hoeveelheid gevormd neerslag bepalen. 1mol Al 2 (SO 4 ) 3 – 3mol BaCl 2 0,010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2
De eerste stap om het werkelijke verloop van een reactie te kennen, is het bepalen van het werkelijke aantal mol van de stoffen die bij de reactie betrokken zijn. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol De tweede stap is om het tekort aan substraat te bepalen op basis van de stoichiometrie van de reactie – dit zal de hoeveelheid gevormd neerslag bepalen. 1mol Al 2 (SO 4 ) 3 – 3mol BaCl 2 0,010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2 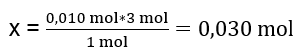 Om de reactie volledig uit te voeren, met 0,010 mol Al 2 (SO 4 ) 3 , is het noodzakelijk om 0,030 mol BaCl 2 aan het systeem toe te voegen. Er reageert echter slechts 0,025 mol bariumchloride, wat betekent dat er een tekort is en de reactie wordt beperkt. Daarom moet de hoeveelheid neerslag die tijdens de reactie wordt gevormd, worden berekend op basis van de hoeveelheid van dit substraat. Het aantal mol bariumchloride dat wordt gebruikt volgens de stoichiometrie van de reactie is gelijk aan het aantal mol van het gevormde neerslag, dus: n BaSO4 = n BaCl2 0,025 mol BaSO 4 = 0,025 mol BaCl 2 Het kennen van het aantal mol barium sulfaat, kunnen we de massa ervan berekenen: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g De reacties en hoeveelheden substraten die in de taak worden gegeven, produceren 5,835 g bariumsulfaatneerslag.
Om de reactie volledig uit te voeren, met 0,010 mol Al 2 (SO 4 ) 3 , is het noodzakelijk om 0,030 mol BaCl 2 aan het systeem toe te voegen. Er reageert echter slechts 0,025 mol bariumchloride, wat betekent dat er een tekort is en de reactie wordt beperkt. Daarom moet de hoeveelheid neerslag die tijdens de reactie wordt gevormd, worden berekend op basis van de hoeveelheid van dit substraat. Het aantal mol bariumchloride dat wordt gebruikt volgens de stoichiometrie van de reactie is gelijk aan het aantal mol van het gevormde neerslag, dus: n BaSO4 = n BaCl2 0,025 mol BaSO 4 = 0,025 mol BaCl 2 Het kennen van het aantal mol barium sulfaat, kunnen we de massa ervan berekenen: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g De reacties en hoeveelheden substraten die in de taak worden gegeven, produceren 5,835 g bariumsulfaatneerslag.
