Elektronegativiteit is een grootheid die de neiging weerspiegelt van een bepaald atoom binnen een molecuul om elektronen naar zichzelf toe te trekken. In de praktijk is het het vermogen van een atoom of functionele groepen om elektronendichtheid aan te trekken. De meest gebruikte schaal die bij deze hoeveelheid hoort, is die geïntroduceerd door Linus Pauling, die het mogelijk maakt om eenvoudig de aard van de binding bij benadering te berekenen.

Elektronegativiteitskenmerken
Homonucleaire moleculen, bijvoorbeeld H 2 en O 2 , hebben gelijke coëfficiënten c A en c B in hun moleculaire orbitalen, die kunnen worden vastgelegd als golffuncties: Ψ +AB = c A Ψ A + c B Ψ B Ψ −AB = c A Ψ A − c B Ψ B In dit geval wordt de orbitaal gekenmerkt doordat zijn vorm symmetrisch is ten opzichte van het midden van het molecuul, en zijn elektrische lading daarin gelijk symmetrisch verdeeld is. Een ander voorbeeld zijn echter heteronucleaire moleculen, waarbij het vrijwel onmogelijk is om gelijke coëfficiënten te behouden, evenals volledige symmetrie ten opzichte van het midden van het molecuul. Wanneer het energieniveau van atomaire orbitaal Ψ B lager is dan het energieniveau van atomaire orbitaal Ψ A , treedt de relatie op en wordt het maximum van de elektronenkansdichtheid verschoven naar atoom B. In de praktijk resulteert dit in een verschuiving van het elektron paar in de chemische binding, dwz polarisatie naar atoom B. In het lithiumhydridemolecuul LiH is deze verschuiving bijvoorbeeld richting het waterstofatoom, terwijl deze in het waterstoffluoridemolecuul HF naar het fluoratoom gaat. Dit betekent dat het waterstofatoom een lager energieniveau heeft dan lithium, maar een hoger energieniveau dan fluor (lees over halogenen ). Onder deze omstandigheden neemt een van de atomen van beide moleculen een negatieve lading aan, aangeduid als -δ, en de andere is positief +δ. De algemene formule van zo’n molecuul is A +δ B -δ .
Ladingen van atomen
De bovengenoemde lading δ kan verschillende waarden aannemen, afhankelijk van de elementen die door de chemische binding gebonden zijn. De waarde 0 betekent dat de lading van het elektronenpaar symmetrisch verdeeld is en dat het paar zich volledig in de buurt van het atoom met een lager energieniveau bevindt, wat resulteert in de overdracht van beide elektronen naar dat atoom. Hierdoor ontstaat er een ionische binding tussen de elementen. In de overgrote meerderheid van chemische bindingen zijn er echter fractionele ladingen, wat resulteert in een toestand tussen covalente en ionische binding.
Dipoolmoment
Een dipool is een molecuul waarin twee polen – positief en negatief – te onderscheiden zijn. Het dipoolmoment, aangegeven met μ, is een maat voor de grootte van de elektrische ladingsverschuiving daarin. Het wordt gedefinieerd als het product van de absolute waarde van de elektrische lading (δ) in een van de polen en de afstand tot deze polen (l): μ = δ · l Een positieve lading (δ+) en een negatieve lading ( δ-) wordt een gedeeltelijke lading genoemd en de locatie ervan wordt toegeschreven aan een bepaald atoom, maar in werkelijkheid is dit slechts de grotere of kleinere waarschijnlijkheid dat er een elektron rond hun kernen aanwezig is. Een dergelijk fenomeen wordt soms verward met de processen van oxidatie en reductie , maar in tegenstelling tot de veranderingen die daarin plaatsvinden, zorgt het feit dat dergelijke ladingen door de atomen worden opgenomen er niet voor dat ze naar een andere oxidatietoestand gaan. Er is dus geen elektronenuitwisseling tussen de atomen. hen. De SI-eenheid voor het uitdrukken van het dipoolmoment is de coulombmeter (C·m). Bij berekeningen wordt echter de in het CGS-systeem geschreven eenheid, de debye (D), het meest gebruikt. Eén debye komt overeen met een waarde van 3,33564·10 -30 C·m. Het grootste theoretisch mogelijke dipoolmoment kenmerkt moleculen met een puur ionische binding. Terwijl de kleinste voorkomt in moleculen waarvan de binding puur covalent is – het dipoolmoment is in dit geval nul. De meeste zijn echter tussenliggende gevallen met variërende deeltjeskarakters.
Halogeen dipoolmoment
Verschillende relaties tussen elektronegativiteit en dipoolmoment kunnen gemakkelijk worden waargenomen op specifieke chemische verbindingen. Tabel 1 Dipoolmomenten van waterstofhalogeniden
| Verbinding | Experimenteel bepaald dipoolmoment [ μ, D] | Lengte van de obligatie [pm] | Product van elementaire lading en dipoollengte [e ·l, D] | Aandeel van ionisch karakter [ %] | Verschil in de elektronegativiteit van halogeen en waterstof |
| HF | 1,98 | 92 | 4.42 | 45 | 1.9 |
| HCl | 1.08 | 128 | 6.15 | 18 | 0,9 |
| HBr | 0,79 | 143 | 6,87 | 12 | 0,7 |
| HOI | 0,38 | 162 | 7,78 | 5 | 0,4 |
De verhouding μ/(e·l’), dwz het werkelijke dipoolmoment ten opzichte van het dipoolmoment dat overeenkomt met een ionenbinding, kan een maatstaf zijn voor afwijkingen van de volledig covalente binding. Het product van deze relatie in de vorm van (μ/(e·l’))·100%vertegenwoordigt het percentage van het ionische karakter in de binding. Dit is slechts een geschatte waarde, aangezien het dipoolmoment niet alleen afhangt van de polariteit van de binding, maar ook van het gedrag van de vrije elektronenparen. Het komt voor dat de elektronenwolk naar de buitenkant van het molecuul kan worden verschoven, met als gevolg dat de vergelijking voor het bepalen van het dipoolmoment een extra component heeft. In het geval van het ammoniakmolecuul wordt de wolk gericht in lijn met het dipoolmoment van de binding, wat resulteert in een toename van het resulterende dipoolmoment. Het tegenovergestelde geldt daarentegen voor het koolmonoxidemolecuul, waar de wolk in de tegenovergestelde richting is gericht en daardoor het resulterende dipoolmoment vermindert. 
Elektronegativiteit
Het is een dimensieloze empirische grootheid die de neiging weerspiegelt van een bepaald atoom binnen een molecuul om elektronen naar zichzelf toe te trekken. In de praktijk is het het vermogen van een atoom of functionele groepen om elektronendichtheid aan te trekken. De meest gebruikte schaal die bij deze hoeveelheid hoort, is die geïntroduceerd door Linus Pauling, die het mogelijk maakt om eenvoudig de aard van de binding bij benadering te berekenen. De wetenschapper gebruikte de volgende methode om de elektronegativiteit van de individuele elementen te berekenen: We nemen aan dat D AA en D BB de bindingsenergieën zijn van de tweeatomige moleculen (A 2 , B 2 ). De bindingsenergie die in het molecuul optreedt duiden we aan als DAB . Empirisch is aangetoond dat als een dergelijke binding weinig of geen ionisch karakter bevat, het verschil tussen de DAB- waarden en het geometrische gemiddelde van de DAA- en DBB- energiewaarden gelijk is aan of dichtbij nul is. Wanneer de AB-binding duidelijke afwijkingen vertoont van het covalente karakter, neemt dit verschil positieve waarden aan, die toenemen naarmate het aandeel van het ionische karakter toeneemt. Het verschil tussen de elektronegativiteit (x) van de twee atomen die bij de binding betrokken zijn, wordt uitgedrukt door de formule: ![]() Als Pauling in zijn berekeningen uitgaat van een elektronegativiteit van fluor van 4,0, is het dus mogelijk om de daaropvolgende elektronegativiteiten van de elementen te berekenen. Als we de x A- waarde van de atomen van element A en de waarde van de coëfficiënt Δ’ kennen, kunnen we de x B- waarde berekenen met behulp van de bovenstaande vergelijking. De Pauling-schaal is zo geconstrueerd dat de waarden ervan ongeveer overeenkomen met de waarden van het dipoolmoment van de binding gevormd door de beschouwde atomen, zoals we kunnen zien aan het voorbeeld in Tabel 1, dat de waarden bevat die zijn bepaald voor waterstofhalogeniden . Naast de hierboven beschreven schaal zijn er nog een aantal beschreven in de wetenschappelijke literatuur, waaronder de elektronegativiteit die wordt beschreven door:
Als Pauling in zijn berekeningen uitgaat van een elektronegativiteit van fluor van 4,0, is het dus mogelijk om de daaropvolgende elektronegativiteiten van de elementen te berekenen. Als we de x A- waarde van de atomen van element A en de waarde van de coëfficiënt Δ’ kennen, kunnen we de x B- waarde berekenen met behulp van de bovenstaande vergelijking. De Pauling-schaal is zo geconstrueerd dat de waarden ervan ongeveer overeenkomen met de waarden van het dipoolmoment van de binding gevormd door de beschouwde atomen, zoals we kunnen zien aan het voorbeeld in Tabel 1, dat de waarden bevat die zijn bepaald voor waterstofhalogeniden . Naast de hierboven beschreven schaal zijn er nog een aantal beschreven in de wetenschappelijke literatuur, waaronder de elektronegativiteit die wordt beschreven door:
- Mulliken, wiens werk ervan uitging dat de elektronegativiteit van een element recht evenredig is met de som van zijn elektronenaffiniteit en ionisatie-energie. Elektronenaffiniteit, de hoeveelheid energie die vrijkomt als gevolg van de hechting van een elektron aan een neutraal atoom, en de ionisatie-energie gelijk aan de hoeveelheid energie die nodig is om een elektron los te maken van een neutraal atoom. De hoogste elektronegativiteiten zijn daarom kenmerkend voor atomen die een hoge elektronenaffiniteit en hoge ionisatie-energie vertonen.
- Allred en Rochow, die de evenredigheid van de elektronegativiteit aannamen met de maat van de kracht waarmee de atoomkern (Z) inwerkt op de valentie-elektronen, geregistreerd als
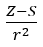 (r – atoomstraal, S – screeningconstante). Volgens hun theorie kan de elektronegativiteit (x) van de elementen worden berekend met behulp van de formule:
(r – atoomstraal, S – screeningconstante). Volgens hun theorie kan de elektronegativiteit (x) van de elementen worden berekend met behulp van de formule:
![]() Op elke schaal ligt de elektronegativiteit van waterstof dicht bij de waarde van 2,2, terwijl andere waarden enigszins variëren. Voorbeelden van de elektronegativiteiten van elementaire atomen berekend volgens de schalen van Pauling, Mulliken en Allred en Rochow worden weergegeven in Tabel 2 hieronder. Tabel 2 Elektronegativiteiten van voorbeeldelementen op de schalen van Pauling (P), Mulliken (M) en Allred en Rochow (AR)
Op elke schaal ligt de elektronegativiteit van waterstof dicht bij de waarde van 2,2, terwijl andere waarden enigszins variëren. Voorbeelden van de elektronegativiteiten van elementaire atomen berekend volgens de schalen van Pauling, Mulliken en Allred en Rochow worden weergegeven in Tabel 2 hieronder. Tabel 2 Elektronegativiteiten van voorbeeldelementen op de schalen van Pauling (P), Mulliken (M) en Allred en Rochow (AR)
| Atoom | P | M | AR |
| F | 3,98 | 3,90 | 4.10 |
| O | 3.44 | 3.04 | 3,50 |
| N | 3.04 | 2.28 | 3.07 |
| Kl | 3.16 | 2,95 | 2,83 |
| C | 2,55 | 1,75 | 2,50 |
| H | 2.20 | 2.21 | 2.20 |
| Si | 1,90 | 2.25 | 1,74 |
| F | 0,82 | 0,77 | 0,91 |
| Rb | 0,82 | 0,50 | 0,89 |
| Cs | 0,79 | – | 0,86 |
| Fr | 0,70 | – | 0,86 |
Ondanks de discrepanties in de berekeningen met de drie methoden, heeft fluor op elke schaal de hoogste elektronegativiteit, gevolgd door zuurstof, stikstof en chloor . De laagste waarden werden bepaald voor frank, cesium, rubidium en kalium. Elementen die typisch niet-metalen zijn, hebben elektronegativiteiten boven de waarde van 2, typische metalen hebben elektronegativiteiten onder de 2. De standaardwaarde is de bovengenoemde elektronegativiteit van waterstof van ongeveer 2,2. 
Elektronegativiteit in het periodiek systeem
Net als veel andere eigenschappen wordt elektronegativiteit ook weerspiegeld in de rangschikking van de chemische elementen in het periodiek systeem . In de groep neemt de elektronegativiteit af met een toenemend aantal schillen en metallisch karakter, dus neemt deze toe in de richting van frank naar waterstof. Na verloop van tijd neemt de elektronegativiteit toe met een toename van de aanwezige valentie-elektronen en een afname van het niet-metallische karakter, dus van metalen naar edelgassen .
Elektronegativiteit en bindingstype – samenvatting
Door de individuele waarden van de elektronegativiteit van de elementen die de chemische binding vormen te kennen, kunnen we de aard ervan afleiden. Als het verschil tussen 0,0 en 0,4 ligt, is de binding covalent. Wanneer het verschil tussen 0,4 en 1,7 ligt, is de binding covalent gepolariseerd. Een verschil van meer dan 1,7 in de elektronegativiteit van de elementen duidt op ionische binding.
