Z definicji, aktywność chemiczna to zdolność pierwiastka do oddawania elektronów w reakcjach chemicznych. W praktyce ich aktywność wzrasta wraz ze spadkiem elektroujemności, a więc miary zdolności pierwiastka do przyciągania elektronów. Jeżeli metal słabiej przyciąga elektrony, jest bardziej reaktywny. Do klasyfikacji aktywności chemicznej metali wykorzystuje się pierwiastek odniesienia – wodór. Miarą aktywności metalu jest jego zdolność do wypierania przez niego wodoru z kwasów lub wodoru z cząsteczki wody.

Szereg aktywności chemicznej metali
Tym mianem określa się zestawienie pierwiastków chemicznych, które posiadają charakter metaliczny, w konkretnej kolejności – od najmniej do najbardziej aktywnego pod względem chemicznym. Służy to do porównywania aktywności różnych metali. Oprócz metali, w szeregu aktywności chemicznej, znajduje się również jeden niemetal – wodór, który stanowi pierwiastek odniesienia.
Im wyżej w szeregu aktywności znajduje się metal, tym bardziej jest reaktywny. Wiąże się to również z tym, że łatwiej ulega utlenieniu, a więc jest silniejszym reduktorem i pierwiastkiem bardziej aktywnym chemicznie. W przeciwieństwie do tego im niżej w szeregu aktywności znajduje się metal, tym mniej reaktywny jest. Oznacza to, że łatwiej ulega reakcji redukcji, a więc jest silniejszym utleniaczem, pierwiastkiem mniej aktywnym.
Posługując się wartościami widocznymi w Tabeli 1., możemy zauważyć, że im niższa wartość potencjału standardowego pierwiastka, tym silniejszym jest on reduktorem i tym bardziej reaktywnym chemicznie metalem. Miarą zdolności do oddawania elektronów w szeregu aktywności metali jest ich wartość potencjału standardowego. Dla wodoru, a właściwie elektrody wodorowej, potencjał standardowy przyjmuje się jako zero. Potencjał standardowy to siła elektromotoryczna ogniwa zbudowanego ze standardowego półogniwa wodorowego oraz interesującego nas półogniwa, w którym stężenia substratów i produktów wynoszą 1 mol/dm3.
| Elektroda | Potencjał standardowy [V] |
| Li/Li+ | -3,04 |
| Ca/Ca2+ | -2,86 |
| Mg/Mg3+ | -2,36 |
| Al/Al3+ | -1,69 |
| Mn/Mn2+ | -1,18 |
| Zn/Zn2+ | -0,76 |
| Cr/Cr3+ | -0,74 |
| Fe/Fe2+ | -0,44 |
| Cd/Cd2+ | -0,40 |
| Co/Co2+ | -0,28 |
| Ni/Ni2+ | -0,26 |
| Sn/Sn2+ | -0,14 |
| Pb/Pb2+ | -0,14 |
| Fe/Fe3+ | 0,04 |
| H2/2H+ | 0,00 |
| Bi/Bi3+ | +0,32 |
| Cu/Cu2+ | +0,34 |
| Ag/Ag+ | +0,80 |
| Hg/Hg2+ | +0,85 |
| Au/Au3+ | +1,52 |
Tabela 1. Szereg elektrochemiczny metali
Najaktywniejsze są metale widoczne na samej górze szeregu. Te, które znajdują się powyżej wodoru, wykazują tendencję do łatwego utleniania się, a więc są silniejszymi od niego reduktorami. Pierwiastki znajdujące się poniżej wodoru w szeregu, łatwiej ulegają redukcji i są silniejszym utleniaczami. Jeżeli metal charakteryzuje się bardziej ujemnym potencjałem od innego, oznacza to, że wyprze go z jego soli. Przykładowo, żelazo wyprze miedź w solach miedzi, ale miedź nie wyprze żelaza z jego soli. Może natomiast wyprzeć srebro z soli srebra. Litowce oraz berylowce z roztworów soli innych metali nie wypierają ich, reagują one natomiast bezpośrednio z wodą. Wypierają z niej wodór i wytwarzają swoje związki – wodorotlenki. Takie metale nazywamy metalami aktywnymi.
Aktywność metali a układ okresowy pierwiastków
Jak wiele innych właściwości, aktywność chemiczna pierwiastka może być sugerowana przez jego położenie w układzie okresowym. Najbardziej aktywne są metale, które znajdują się w I. i II. grupie, gdyż w łatwy sposób wypierają wodór z wody, tworząc wodorotlenki. W grupie aktywność chemiczna metali wzrasta wraz ze wzrostem liczby atomowej. W okresie maleje wraz ze wzrostem liczby atomowej.

Metale szlachetne i nieszlachetne
Wodór nie tylko stanowi punkt odniesienia aktywności, ale również oddziela w szeregu metale szlachetne od nieszlachetnych. Metalami nieszlachetnymi nazywamy te znajdujące się powyżej wodoru. Każdy z nich reaguje z kwasami, wypierając z nich wodór. Od potasu do wapnia reagują one z wodą już w temperaturze pokojowej, a od magnezu do żelaza reagują z nią w podwyższonej temperaturze.
Wszystkie metale będące poniżej wodoru w szeregu aktywności, nie wypierają wodoru z kwasów. Mogą jednak reagować z kwasami utleniającymi, w wyniku czego tworzą odpowiednie sole i tlenki, które powstają poprzez redukcję reszty kwasowej.
Pierwiastki znajdujące się najniżej w szeregu, od srebra do złota, są tak bardzo odporne na reakcje chemiczne, że reagują wyłącznie z wodą królewską. Taki roztwór to mieszanina stężonego roztworu kwasu solnego i stężonego roztworu kwasu azotowego (V), zmieszanych w stosunku objętościowym 3:1. Znając te fakty, możemy wywnioskować, że w celu rozróżnienia aktywności interesującego nas pierwiastka można przeprowadzić kilka jego reakcji: z wodą w temperaturze pokojowej, z wodą na gorąco, z kwasem nieutleniającym, z kwasem utleniającym oraz wodą królewską.
Doświadczenie na wykrycie metali wypierających wodór z kwasów
Najłatwiejszym sposobem na potwierdzenie aktywności metalu jest przeprowadzenie doświadczenia. W tym celu należy przygotować dziesięć probówek, w których umieści się kolejno: w 1-5: wstążkę magnezową, drucik cynkowy, drucik żelazny, drucik niklowy oraz drucik miedziany. Tę samą kolejność należy powtórzyć w probówkach 6-10. Następnie do probówek 1-5 należy dodać kilka mililitrów kwasu chlorowodorowego, a do probówek 6-10 kilka mililitrów rozcieńczonego kwasu siarkowego (VI). Do każdej probówki należy przyłożyć zapalone łuczywo. W probówkach, które zawierają wstążki magnezowe oraz druciki żelaza, cynku i niklu, zalane kwasami, wydzielają się pęcherzyki gazu. Najbardziej intensywne wydzielanie można zaobserwować w probówkach zawierających magnez. Reakcje, które zachodzą to:
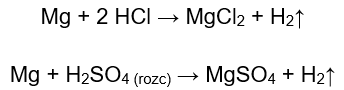
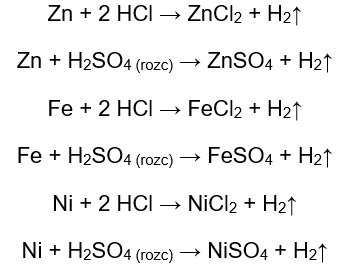
Ilość wydzielającego się gazu maleje w szeregu: cynk, żelazo, nikiel. Zachodzą tam odpowiednio reakcje:
W probówkach, które zawierały druciki miedziane nie widać wydzielającego się gazu, brak zmian. Oznacza to, że takie reakcje nie zachodzą:
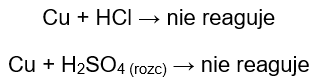
Po przyłożeniu palącego się łuczywka, w probówkach, z których wydziela się gaz, słychać charakterystyczny dźwięk.
Podsumowanie obserwacji i wnioski:
Magnez, cynk, żelazo oraz nikiel reagują zarówno z kwasem chlorowodorowym, jak i z kwasem siarkowym (VI). Każdy z nich wypiera wodór z kwasu, co oznacza, że znajdują się w szeregu aktywności metali wyżej od niego. W reakcjach powstają produkty w postaci soli i uwalniającego się gazu – wodoru.
Charakterystyczny dźwięk, który towarzyszył przykładaniu żarzącego się łuczywka do probówki z ulatniającym się gazem, jest spowodowany reakcją wodoru z tlenem.
Spośród wszystkich badanych metali najbardziej reaktywny jest magnez, a następnie kolejno cynk, żelazo, nikiel, miedź. Możemy to stwierdzić, ponieważ intensywność wydzielania się pęcherzyków gazu świadczy o aktywności metalu.
W probówkach, które zawierały miedź, nie zaobserwowano żadnych zmian. Świadczy to o tym, że miedź nie jest w stanie wyprzeć wodoru ani z kwasu chlorowodorowego, ani z rozcieńczonego kwasu siarkowego (VI).