Inaczej kwasy aminowe, jest to grupa związków organicznych, których budowa strukturalna składa się z atomów węgla, azotu, wodoru tlenu, a także ze zmiennej grupy łańcucha bocznego. Są związkami dwufunkcyjnymi, a ich cząsteczki zawierają grupy karboksylowe COOH oraz aminowe NH2.

Wzór ogólny aminokwasów to:
NH2 – R – COOH
Nazwa stanowi skrót od pełnego określenia kwas α-amino karboksylowy. Mówiąc o poszczególnych rodzajach aminokwasów powszechnie stosuje się zamiast nazw systematycznych, nazwy zwyczajowe związków. Na przykład, kwas aminooctowy to glicyna, kwas 2-aminopropanowy to alanina a kwas 2-amino-3-metylobutanowy to walina.
Podział aminokwasów
Główny podział aminokwasów to ten na białkowe i niebiałkowe. Pierwszą z grup stanowi około 20 związków, a każdy z nich wchodzi w skład białek i mają kluczowe znaczenie dla organizmu człowieka. Białka te, występujące również jako cząsteczki budulcowe w roślinach i zwierzętach, pełnią fundamentalną rolę biorąc udział w wielu mechanizmach odpowiedzialnych za utrzymanie homeostazy w ludzkich organizmach. Inny sposób kategoryzacji uwzględnia możliwość wytwarzania danego aminokwasu lub konieczność dostarczania go wraz z pożywieniem do organizmu człowieka.
Aminokwasy egzogenne i endogenne
Aminokwasy egzogenne są związkami organicznymi, koniecznymi do zachowania w organizmie homeostazy, jednak nie są zdolne do samo wytwarzania. Z tego względu, konieczne jest ich dostarczanie w postaci odpowiedniej diety, wraz z odpowiednio zbilansowanymi posiłkami oraz w formie odpowiednich suplementów. Do tej grupy aminokwasów należą:
- Lizyna, aminokwas antywirusowy oraz podnoszący odporność;
- Metionina, regulująca wytwarzanie hormonu wzrostu;
- Treonina, odpowiadająca za prawidłowe utrzymywanie nawilżenia skóry oraz prawidłowe funkcjonowanie układu nerwowego;
- Leucyna, której główną funkcją jest regulacja poziomu wydzielanego kortyzolu, regulacja poziomu cukru oraz wspomaganie procesu gojenia ran;
- Izoleucyna, aminokwas biorący udział w mechanizmach metabolicznych mięśni, z ukierunkowaniem na tkanki mięśniowe;
- Walina, wspomagająca regenerację mięśni i wspomagająca pozbywanie się nadmiernej ilości tkanki tłuszczowej;
- Tryptofan, czyli prekursor serotoniny, który ma na celu poprawę jakości snu i podniesienia samopoczucia oraz regulację apetytu;
- Fenyloalanina, będąca prekursorem licznych ważnych dla organizmu hormonów, w tym tyrozyny, dopaminy, epinefryny oraz noradrenaliny.
Drugą kategorią aminokwasów są kwasy aminowe endogenne, których synteza odbywa się regularnie w organizmie człowieka, dzięki czemu zapotrzebowanie na nie jest stale pokryte w sposób samowystarczalny. W tej grupie znajduje się większa ilość aminokwasów, w tym:
- Alanina, czyli aminokwas odpowiedzialny za transport glukozy do czerwonych krwinek oraz mózgu;
- Kwas asparginowy, który poprawia sprawność umysłową oraz poprawia zdolność koncentracji;
- Asparagina, wspomagająca liczne procesy, takie jak uczenie się, zapamiętywanie oraz poprawę koncentracji;
- Kwas glutaminowy, który wspomaga procesy trawienia, a także zmniejsza uczucie zmęczenia i wspomaga pamięć.
Aminokwasy warunkowo niezbędne
To takie związki, których produkcja w organizmie jest możliwa, ale jedynie w przypadku dostępu do odpowiednich ilości ich prekursorów. Należą do nich:
- Arginina, opóźniająca procesy starzenia się, mająca wpływ na szybkość gojenia się ran oraz na poprawę wydolności fizycznej;
- Cysteina, stanowiąca budulec w trakcie formowania się glutationu oraz będąca ważnym elementem produkcyjnym kolagenu;
- Glutamina, wspomagająca pracę jelit oraz oczyszczanie organizmu ze zbędnych produktów przemiany materii;
- Tyrozyna, która podobnie jak cysteina bierze udział w procesie produkcji kolagenu, jest również niezbędna podczas syntezy melaniny i wpływa na utrzymanie homeostazy tarczycy;
- Glicyna, będąca aminokwasem o potencjale leczniczym zapalenia stawów i cukrzycy;
- Ornityna, mająca zdolność do obniżenia poziomu kortyzolu, poprawy jakości snu, a także do polepszenia wydajności w pracy jelit oraz enzymów trawiennych;
- Prolina, która wpływa na dobrą kondycję skóry oraz poprawę jej elastyczności;
- Seryna, skierowana na procesy wspomagające układ odpornościowy oraz pracę neuronów.
Aminokwasy białkowe
Jak sugeruje nazwa – istnieją również aminokwasy, będące składnikami białek. Dokładniej mówiąc, białka to połączone ze sobą aminokwasy różnego rodzaju. Jest ich dwadzieścia i w trakcie syntezy są one kodowane przez tzw. kodony (sekwencje trzech nukleotydów zawartych w mRNa stanowiących jednostkę kodującą). Każdy z nich ma dwie wspólne cechy – są alfa i L-aminokwasami. Oznacza to, że ich grupa aminowa jest przyłączona do węgla alfa, bezpośrednio sąsiadującego z grupą karbonylową. Literka „L” oznacza natomiast stereoizomer w projekcji Fishera, a więc grupa aminowa znajduje się po lewej stronie wzoru.
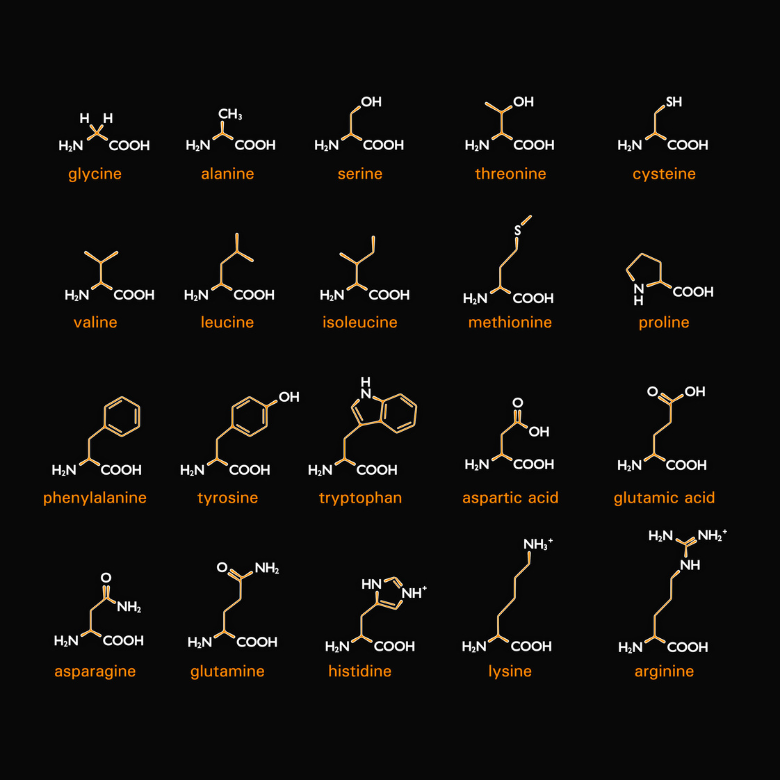
Właściwości fizykochemiczne aminokwasów
Postać fizyczna aminokwasów to w większości krystaliczne ciało stałe o słodkim smaku. Ich rozpuszczalność w wodzie jest dobra, nie rozpuszczają się natomiast w rozpuszczalnikach organicznych. Ich temperatury topnienia są stosunkowo wysokie. Chemiczny charakter aminokwasów jest amfoteryczny, a odczyn roztworów wodnych jest obojętny. Ulegając dysocjacji, powstają jony obojnacze, będące wynikiem zobojętnienia zasadowej grupy aminowej, resztą karboksylową. Skutkuje to powstaniem wewnętrznej soli amoniowej, która wykazuje obydwa ładunki – dodatni oraz ujemny. Ich ilość jest równa sobie. W zależności od środowiska, w którym dysocjuje aminokwas może wystąpić w formie kationu lub anionu. W przypadku odczynu kwaśnego, grupa karboksylowa nie dysocjuje, a aminokwas przyjmuje ładunek dodatni. Natomiast w środowisku alkalicznym, reakcja przesuwa się w kierunku wytwarzania jonu o charakterze ujemnym.
Punkt izoelektryczny (pI)
Jest to punkt, w którym aminokwas przyjmuje postać jonu obojnaczego. Dla każdej cząsteczki można dostosować odpowiednie stężenie jonów [H3O+], a więc takie pH, w którym nie odbywa się wędrówka jonów w polu elektrycznym. Amfoteryczność aminokwasów oraz ich występowanie w formie jonu obojnaczego skutkuje jonową budową soli pod wpływem działania kwasami i alkaliami. Doświadczalne wyznaczenie punktu izoelektrycznego odbywa się, poprzez dodawanie aminokwasu, na przykład kazeiny do odpowiednich probówek z roztworami (CH3COOH i CH3COONa) o znanych stężeniach pH. Osiągnięcie punktu izoelektrycznego jest obserwowane tam, gdzie występuje najbardziej obfity osad. Ze względu na charakterystykę punktu izoelektrycznego, można wykorzystać go do rozdzielenia mieszaniny białek z wykorzystaniem elektroforezy. Metoda opiera się na właściwościach kwasowo-zasadowych aminokwasów, a mieszaninę umieszcza się na zwilżonym papierze. Przy zastosowaniu znanego nam pH możemy ustalić w jakiej formie będą występowały konkretne aminokwasy. Następnie, dostarczając do papieru napięcie, dodatnio naładowane aminokwasy będą wędrowały w kierunku katody (-), a te o ładunku ujemnym do anody (+). Związki o ładunku neutralnym, zrównoważone przez ładunki dodanie i ujemne w cząsteczce, pozostaną w tym samym miejscu.
Reakcje charakterystyczne dla grupy karboksylowej
- Estryfikacja, polegająca na syntezie estrów, powstałych w wyniku reakcji aminokwasu z alkoholem. Produkt reakcji nie posiada charakteru amfoterycznego, natomiast wykazuje właściwości zastosowanej aminy
- Dekarboksylacja, czyli ogrzewanie aminokwasy w obecności roztworu wodorotlenku baru(II) (Ba(OH)2). W wyniku takiej przemiany powstają aminy.
- Tworzenie kompleksów, polega na zdolności aminokwasów do łączenia się z kationami metali, głównie miedzi, podczas której dochodzi do powstawania barwnych związków – soli kompleksowych.

Reakcje charakterystyczne dla grupy aminowej
- Deaminacja, której podlegają aminokwasy, zawierające w swojej strukturze I-rzędową grupę aminową. Reakcja zachodzi pod wpływem kwasu azotowego (III) – HNO2, a zastosowany w roli reagentu aminokwas, utlenia się z wytworzeniem hydrokwasu. Grupa aminowa uwalniana jest w postaci azotu. Istnieje kilka typów deaminacji, w tym hydrolityczna, hydrolityczna z dekarboksylacją, deaminacja przez redukcję oraz desaturatywna.
- Utlenianie, w wyniku którego aminokwasy ulegają przekształceniu do ketokwasów.
- Reakcje biochemiczne – wszystkie aminokwasy, które mogą być zakwalifikowane jako zasady Schiffa wykazują możliwość do przemian biochemicznych, takich jak transmitancja oraz dekarboksylacja.
Reakcje, służące do wykrywania aminokwasów
- Reakcja ninhydrynowa to barwna reakcja, w której reagentami są aminokwas oraz odczynnik w postaci roztworu ninhydryny. W wyniku reakcji powstaje charakterystyczne fiołkowo-niebieskie zabarwienie.
- Reakcja ksantoproteinowa to przykład drogi wykrywania aminokwasów aromatycznych, takich jak na przykład fenyloalanina, tyrozyna czy też tryptofan. W wyniku działania na związek, stężonym roztworem kwasu azotowego (V) – HNO3, obserwuje się żółte zabarwienie. Jest ono wynikiem powstawania w trakcie reakcji pochodnych nitrowych aminokwasów.
Źródła aminokwasów
Ze względu na dobry stan zdrowia psychicznego oraz fizycznego organizmów ludzkich, należy dostarczać odpowiednie ilości każdego budulca, w tym aminokwasów. Bardzo ważnym źródłem wszystkich, niezbędnych do prawidłowego funkcjonowania, aminokwasów są białka pełnowartościowe. Zaliczamy do nich mięsa, a w szczególności drób i ryby, jajka oraz nabiał. W mleku możemy odnaleźć duże ilości leucyny, izoleucyny, treoniny oraz tryptofanu. Lizynę oraz metioninę znajdziemy w soi. Walinę dostarczymy do organizmu z ryżem, orzeszkami ziemnymi, sezamem oraz migdałami, a fenyloalaninę – wdrażając do diety jaja, sery oraz produkty zbożowe. Występowanie aminokwasów w produktach spożywczych jest powszechne, jednak dla prawidłowego zbilansowania diety, należy wykorzystywać różnorodne produkty. Zawierają one bowiem jedynie niektóre aminokwasy spośród grupy niezbędnych do zachowania prawidłowych funkcji życiowych.