W chemii część związków chemicznych tworzy szczególne połączenia z cząsteczkami wody. Nie są to wiązania chemiczne, a oddziaływania krótkiego zasięgu, które w sposób szczególny decydują o właściwościach tych związków. Są nimi hydraty, nazywane także wodzianami. Ich właściwości są chętnie wykorzystywane w wybranych sektorach przemysłowych. Najpopularniejszą solą uwodnioną jest niewątpliwie gips, czyli dihydrat siarczanu (VI) wapnia, który jest ważnym surowcem w branży budowlanej. Hydraty są także bardzo dobrymi indykatorami zawartości wilgoci. Wiąże się to z tym, że często barwa soli bezwodnej jest inna niż soli uwodnionej.

Hydraty, czyli inaczej wodziany
Hydraty nie są związkami chemicznymi, w których pomiędzy cząsteczkami wody, a cząsteczkami wybranej soli występują wiązania chemiczne, np. kowalencyjne. Nie są to również związki koordynacyjne. Dla tych struktur charakterystyczne jest tworzenie wiązań wodorowych, które mają znacznie słabszą moc niż wiązania chemiczne. Hydraty są zbudowane w formie sieci krystalicznej. Cząsteczki wody są w niej rozmieszczone w sposób nieregularny. Często można się spotkać z określeniem wody krystalizacyjnej.
Hydraty otrzymuje się na drodze hydratacji. Reakcji tej najczęściej ulegają cząsteczki soli, szczególnie pochodne kwasów nieorganicznych. Hydratacja polega na przekształceniu kryształów bezwodnych w uwodnione. Może być przyczyną zmiany masy mineralnej, ale nie powoduje jej niszczenia. Hydratacja często towarzyszy innym procesom, np. karbonatyzacji. Związki chemiczne ulegające hydratacji, w zwykłych warunkach charakteryzują się dużą higroskopijnością, czyli silnym powinowactwem do cząsteczek wody. Takie substancje zdolne są np. do pochłaniania wilgoci z powietrza. Innym sposobem otrzymywania hydratów jest ich krystalizacja z roztworów wodnych.
Wzory sumaryczne hydratów tworzy się poprzez zapis wzoru soli oraz podaniu liczby zhydratowanych cząsteczek wody. Chcąc podać ogólny zapis, przed “H2O” stawiana jest litera “n”. Przyjmuje ona wartości większe od jedynki i odpowiada ilości przyłączonych cząsteczek wody. Najczęściej wyróżnia się hydraty o n=½ (hemihydraty), n= 1 (monohydraty), n=2 (dihydraty) oraz n=3 (trihydraty). Co ważne, ta sama substancja może przyłączać różną ilość cząsteczek wody.
![]()
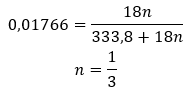
Biorąc pod uwagę to, że pomiędzy cząsteczkami soli a cząsteczkami wody występują wiązania wodorowe, związki te nie wykazują zadowalającej wytrzymałości na podwyższoną temperaturę. Podczas ich ogrzewania, rozpadają się i przechodzą do form bezwodnych. Hydraty bardzo dobrze rozpuszczają się w wodzie. W roztworach wodnych uwolnieniu ulegają przyłączone do soli uwodnione cząsteczki wody. Należy ten fakt uwzględnić np. podczas sporządzania roztworów tych substancji. Nieuwzględnienie stopnia hydratacji danego związku, powoduje błędy chociażby w określeniu stężenia roztworu. Ważną cechą charakterystyczną soli uwodnionych jest zmiana ich zabarwienia, w wyniku przyłączania cząsteczek wody w reakcji hydratacji. Należy zaznaczyć, że formy uwodnione wykazują znacznie mniejszą higroskopijność w porównaniu do soli bezwodnych.
Hydraty związków nieorganicznych
Sole kwasów nieorganicznych, to substancje, które zdecydowanie najchętniej tworzą z cząsteczkami wody hydraty. Do najpopularniejszych hydratów związków nieorganicznych należą:
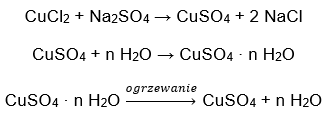
- Hydrat siarczanu (VI) miedzi (II), CuSO4 – siarczan (VI) miedzi (II) przyjmuje różne stopnie hydratacji. Maksymalna ilość przyłączonych cząsteczek wody to pięć. W wyniku ogrzewania pięciowodnego hydratu tej soli, odrywane są cząsteczki wody. Najpierw dwie i powstaje trihydrat, a podczas dalszego podgrzewania układu otrzymać można monohydrat siarczanu (VI) miedzi (II). Aby usunąć ostatnią cząsteczkę wody, konieczne jest ogrzanie związku do temperatury przekraczającej 200 ᵒC. Hydraty siarczanu (VI) miedzi (II) przyjmują zabarwienie niebieskie, które jest spowodowane obecnością wody krystalizacyjnej wokół jonów miedzi. Bezwodna sól ma natomiast barwę białą. Jej duża higroskopijność oraz zdolność do tworzenia hydratów, jest wykorzystywana do usuwania wilgoci z niektórych cieczy.
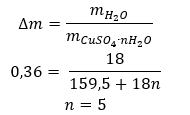
- Hydrat chlorku kobaltu (II), CoCl2 – bezwodny chlorek kobaltu (II) charakteryzuje się dużą higroskopijnością. Dzięki silnemu powinowactwu do cząsteczek wody, jest on zdolny do pochłaniania wilgoci nawet z powietrza. W wyniku tego procesu powstają hydraty tej soli. Najczęściej spotykaną formą uwodnioną jest sześciowodny chlorek kobaltu (II) – CoCl2 * 6H2 Inną formą jest cząsteczka dihydratu. Sól ta również wykazuje zdolność do zmiany zabarwienia w zależności od zawartości wilgoci. Bezwodna sól jest niebieska, dihydrat przyjmuje zabarwienie różowo-fioletowe, a sześciowodna cząsteczka ma intensywnie czerwoną barwę.
- Hydrat siarczanu (VI) sodu, Na2SO4 – sól ta występuje w formie dwóch hydratów: heptahydratu (pięć cząsteczek wody w strukturze) oraz dekahydratu (dziesięć cząsteczek wody w strukturze). Bezwodna forma siarczanu (VI) sodu występuje w naturze, jako rzadki minerał – tenardyt. Dziesięciowodny siarczan (VI) sodu to tak zwana sól glauberska. Znajduje szerokie zastosowanie w produkcji szkła, papieru, środków piorących i sody. Sól glauberska jest także jednym ze składników niezbędnych do wytwarzania niebieskiego pigmentu, jakim jest ultramaryna. Poza tym związek ten wykazuje działanie lecznicze na układ trawienny, ze względu na działanie przeczyszczające.

Gips
Przykładem hydratu soli nieorganicznej o dużym znaczeniu globalnym i szerokim zastosowaniu, jest gips. Jest to minerał zbudowany z uwodnionej formy siarczanu (VI) wapnia, CaSO4. Gips krystaliczny to dihydrat tej soli. W naturalnych warunkach powstaje podczas odparowywania słonych wód jezior i rzek, w temperaturze poniżej 42ᵒC. Bezwodny siarczan (VI) wapnia to anhydryt. Nazywany jest także gipsem bezwodnym. Natomiast gips budowlany to półwodny siarczan (VI) wapnia. To, jaka forma tej soli jest otrzymywana, zależy od temperatury, jaka panuje podczas przerobu macierzystej skały osadowej. Gips wykorzystywany w budownictwie to najczęściej mieszanina różnych form uwodnionej soli wapiennej.
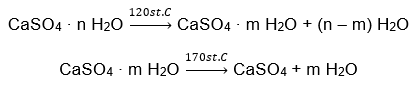
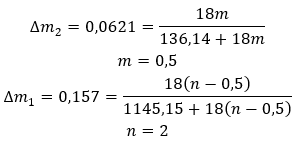
Możliwości zastosowania gipsu są bardzo szerokie, szczególnie w budownictwie. Poniżej zostały wymienione najważniejsze zastosowania hydratu tej soli:
- W budownictwie gips stosowany jest w elementach wykończeniowych. Stanowi jeden ze składników sypkich półproduktów, zapraw, klejów, gładzi gipsowych oraz gotowych elementów montażowych, np. płyt gipsowo-kartonowych.
- Medycyna wykorzystuje gips do usztywniania złamanych kończyn. Bandaże gipsowe są uznawane za przyjazne dla skóry. Ponadto materiał ten jest także wykorzystywany w laboratoriach techniki dentystycznej.
- Przemysł stosuje gips w warsztatach modelarskich i wzorniczych. Odlewy gipsowe bardzo dobrze nadają się do nadawania kształtu różnych przedmiotów użytkowych.
- Gips jest dodatkiem do niektórych nawozów sztucznych, stosowanych w rolnictwie.

Klatraty metanu
Klatraty metanu należą do grupy związków określanych, jako gazohydraty. Odpowiadają one za większość gwałtownych zmian klimatu w historii Ziemi. Klatraty metanu często określane są także, jako wodziany metanu, hydraty metanu czy metanowy lód. Tworzą stałą formę wody i metanu. Ich cząsteczki wyróżniają się budową krystaliczną. Powstają pod zwiększonym ciśnieniem. Przyjmują postać białych, bezwonnych ciał stałych, które często porównywane są pod względem wyglądu zewnętrznego, do lodu. Co ciekawe, w dotyku przypominają styropian. Klatraty to wyjątkowe ugrupowania chemiczne. Cząsteczki wody tworzą strukturę, która budową przypomina klatkę. Wewnątrz tej klatki zgromadzony jest metan. Co ważne, obie substancje nie tworzą ze sobą wiązań chemicznych. Zazwyczaj klatraty metanu składają się z 46 cząsteczek wody, otaczających dwie małe i sześć średnich klatek. Wewnątrz nich uwięzione są cząsteczki metanu. Znane są również klatraty zbudowane ze 136 cząsteczek wody, wewnątrz których znajduje się 16 małych i 8 dużych klatek z gazowym metanem.
W ostatnich latach, na dnie oceanów odkryto znaczne ilości tego surowca. Wzbudza on duże zainteresowanie, ze względu na możliwość pozyskania znacznych ilości metanu, który można wykorzystać np. do celów energetycznych. Klatraty metanu spalają się równym płomieniem, o czerwonawym zabarwieniu. Po spaleniu pozostaje roztopiona woda. Pozyskiwany w ten sposób metan może być dobrą alternatywą dla konwencjonalnych źródeł węglowodorów, ale również sporym zagrożeniem dla klimatu. Nadal niewystarczająca jest wiedza na temat eksploatacji metanu z klatratów zgromadzonych na dnie oceanicznym. Niekontrolowane uwolnienie znacznych ilości tego gazu, może być bardzo niebezpieczne, ponieważ wzmaga on efekt cieplarniany znacznie silniej niż dwutlenek węgla.