Pod względem strukturalnym, kwasy karboksylowe są ważnymi związkami organicznymi, pochodnymi acylowymi. Stanowią swego rodzaju materiały budulcowe dla wielu pochodnych, w tym estrów i amidów. W przyrodzie znajdziemy całą gamę różnorodnych kwasów karboksylowych, takich jak kwas octowy CH3COOH będący podstawowym związkiem octu stołowego, kwas masłowy CH3CH2CH2COOH odpowiedzialny za zapach zjełczałego masła czy też bardziej złożony kwas cholowy, będący podstawowym składnikiem ludzkich soków żółciowych.

Wzór ogólny kwasów karboksylowych to:
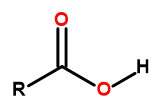
Rysunek 1 Wzór ogólny kwasów karboksylowych.
Nazewnictwo kwasów karboksylowych
Według systemu nazewnictwa IUPAC, kwasy karboksylowe mogą być nazywane dwojako w zależności od wielkości i złożoności cząsteczki. Kwasy, będące alifatycznymi pochodnymi są nazywane w sposób systematyczny poprzez zmianę końcówki alkanu z –an na –owy oraz dodanie początkowego słowa „kwas”, na przykład kwas propanowy, kwas butanowy, kwas 3-etylo-6-metylooktanodiowy. Numeracja atomów węgla w takich związkach chemicznych zawsze rozpoczyna się od atomu, będącego w grupie funkcyjnej –COOH. Drugi system nazewnictwa, użyteczny zwłaszcza dla kwasów, w których grupa karboksylowa przyłączona jest do pierścienia dopuszczone jest dodanie do nazwy systematycznej układu słów „kwas” przed oraz „karboksylowy” po niej. W takich przypadkach numeracja atomów węgla rozpoczyna się od atomu, do którego przyczepiona jest grupa karboksylowa, która sama traktowana jest jako podstawnik.
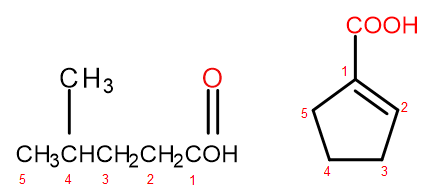
Rysunek 2 Numeracja atomów węgla, od lewej: kwas 4-metylopentanowy, kwas 1-cyklopentenokarboksylowy.
Ze względu na zarys historyczny, według którego kwasy karboksylowe były jednymi z pierwszych wyizolowanych, oczyszczonych oraz scharakteryzowanych związków organicznych, system IUPAC dopuszcza również wiele nazw zwyczajowych zarówno związków organicznych, jak i ich grup acylowych.
Tabela 1 Wybrane przykłady nazw zwyczajowych kwasów karboksylowych oraz ich grup acylowych.
| Kwas karboksylowy | Grupa acylowa | ||
| Struktura | Nazwa | Struktura | Nazwa |
| HCOOH | Mrówkowy | HCO- | Formyl- |
| CH3COOH | Octowy | CH3CO- | Acetyl- |
| CH3CH2CH2COOH | Masłowy | CH3CH2CH2CO- | Butyryl- |
| HOOOCCOOH | Szczawiowy | -OCCO- | Oksalil- |
| HOOC(CH2)2COOH | Bursztynowy | -OC(CH2)2CO- | Sukcynyl- |
Struktura i właściwości fizyczne kwasów karboksylowych
Podobieństwo grupy karboksylowej zarówno do ketonów, jak i do alkoholi może sugerować podobne do nich właściwości fizyczne. Tak samo jak w ketonach, atom węgla grupy funkcyjnej posiada hybrydyzację sp2. Wiąże się to bezpośrednio z jej płaską strukturą oraz kątami około 120o pomiędzy wiązaniami C-C-O oraz O-C-O. Przykładowo, kwas octowy CH3COOH posiada kąty pomiędzy wiązaniami równe:
- 119o dla C-C=O,
- 119o dla C-C-OH,
- 122o dla O=C-OH.
Natomiast długości wiązań wynoszą kolejno:
- 1,52Å dla C-C,
- 1,25Å dla C=O,
- 1,31Å dla C-OH.
Swoje podobieństwo do alkoholi, kwasy karboksylowe wykazują ze względu na ich silne zasocjowanie spowodowane możliwością tworzenia wiązań wodorowych. W praktyce, większość tych związków występuje w postaci cyklicznych dimerów, których struktura utrzymuje się dzięki wytwarzaniu wiązań wodorowych. Taki specyficzny układ wiązań wodorowych wpływa też na temperatury wrzenia kwasów karboksylowych. Powoduje on ich znaczące podwyższenie w porównaniu do odpowiadającym im alkoholi. Dla przykładu, stałe fizyczne – temperatura topnienia i temperatura wrzenia w stopniach Celsjusza wynoszą kolejno dla:
- Kwasu mrówkowego: 8,4; 100,7,
- Kwasu octowego: 16,6; 117,9,
- Kwasu propanowego: -20,8; 141,
- Kwasu benzoesowego: 122,1; 249.
Dysocjacja kwasów karboksylowych
Właściwości kwasowe tej grupy związków powodują możliwość ich reakcji z zasadami, w tym wodorotlenkiem sodu oraz wodorowęglanem potasu. Produktami takich reakcji są sole kwasów karboksylowych. Rozpuszczalność w wodzie kwasów karboksylowych jest znikoma, jednak ich sole z litowcami, przez wzgląd na swoją jonową strukturę, rozpuszczają się w niej bardzo dobrze. Te związki, będące kwasami w teorii Bronsteda-Lowry’ego, dysocjują w rozcieńczonych roztworach wodnych. W wyniku przemiany powstają: anion karboksylanowy RCOO– oraz kation hydroniowy H3O+.
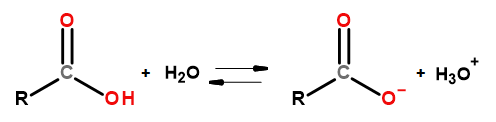
Rysunek 3 Schemat dysocjacji kwasu karboksylowego
Analogicznie jak dla innych kwasów, możliwe jest rozpisanie stałej kwasowej (Ka) oraz jej logarytmu:
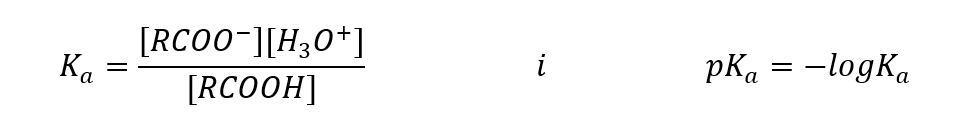
Empirycznie wyznaczone wartości dla kwasów karboksylowych pokazują, że są to związki słabo zdysocjowane, a więc w praktyce stanowią również słabe kwasy. Dla większości z nich, stała Ka przyjmuje wartość około 10-5. Dla kwasu octowego
Ka = 1,76·10-5, co po przeliczeniu daje wartość pKa równą 4,75. Jest to równoznaczne z dysocjacją jedynie około 0,1% cząsteczek, co w porównaniu do silnych kwasów nieorganicznych o stopniu dysocjacji 100% potwierdza, że są to kwasy o niskiej mocy. W porównaniu z alkoholami, których stałe równowagi oscylują w rzędzie wielkości 10-16, kwasy karboksylowe są natomiast o wiele silniejsze. Pomimo ich podobieństwa strukturalnego, ten fakt wynika z trwałości anionu karboksylanowego względem anionu alkoholanowego. Należy pamiętać, że ładunek ujemny w alkoholanach znajduje się na pojedynczym atomie tlenu, który jest silnie elektroujemny. Natomiast w anionach karboksylanowych, ładunek jest zdelokalizowanych pomiędzy dwoma tlenami grupy funkcyjnej. Przez to jest on bardziej trwały w porównaniu do anionu wytwarzanego przez alkohole.
Otrzymywanie kwasów karboksylowych
- Utlenianie podstawionych alkilobenzenów przy pomocy KMnO4 lub Na2Cr2O7 z produktem w postaci podstawionych kwasów benzoesowych. Możliwe jest utlenienie pierwszo- i drugorzędowych grup alkilowych,
- Utlenienie wiązania C=C w alkenach o co najmniej jednym winylowym atomie wodoru przy pomocy KMnO4,
- Utlenianie pierwszorzędowych alkoholi i aldehydów. Alkohole przy pomocy odczynnika Jonesa, natomiast aldehydy z wykorzystaniem tego samego odczynnika oraz zasadowego tlenku srebra,
- Hydroliza nitryli pod wpływem mocnych, gorących roztworów kwasów lub zasad,
- Reakcja związków Grignarda z dwutlenkiem węgla, z produktem pośrednim w postaci karboksylanu magnezu. Następnie związek przejściowy reaguje z kwasem.
Reakcje kwasów karboksylowych
Ze względu na swoją strukturę, kwasy karboksylowe oprócz charakterystycznych dla siebie reakcji, ulegają również przemianom podobnym do alkoholi i ketonów. Tak samo jak alkohole, mogą oddysocjować proton z wytworzeniem odczynnika nukleofilowego. Podobnie jak ketony, ulegają atakom innych czynników nukleofilowych na atom węgla grupy karbonylowej. Dodatkowo, możliwa jest ich redukcja, substytucja w pozycji alfa, substytucja nukleofilowa grupy acylowej oraz deprotonacja (dysocjacja).
Redukcja kwasów karboksylowych zachodzi wobec LiAlH4, dając produkt w postaci pierwszorzędowego alkoholu. Czasami konieczne jest zastosowanie ogrzewania w roztworze tetrahydrofuranowym w celu zwiększenia wydajności. Innym sposobem jest redukcja przy użyciu boranu w roztworze tetrahydrofuranu, również z otrzymaniem alkoholi 1o.