Metody spektroskopowe to grupa metod, w których otrzymywany sygnał powstaje w wyniku oddziaływania promieniowania elektromagnetycznego lub korpuskularnego na badaną próbkę. Takie promieniowanie może powstawać w wyniku okresowych zmian pola elektromagnetycznego związanych z przenoszeniem energii. Metody te zajmują się określaniem stężenia lub zawartości atomów w danym układzie absorbującym, lub emitującym. Jakie rodzaje spektrofotometrii rozróżniamy i na czym polegają te metody? Tego dowiesz się z naszego artykułu.

Promieniowanie i przejścia energetyczne
Najważniejszą własnością fotonów, czyli kwantów promieniowania jest energia. Równanie na wartość energii (E) to iloczyn uniwersalnej stałej Plancka (h) równej 6,626·10-34 [J·s] i częstotliwości drgań promieniowania (v) wyrażonej w hercach [Hz].
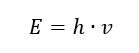
W przypadku spektrofotometrii wykorzystuje się przejścia energetyczne zachodzące w cząsteczkach, które są spowodowane absorpcją lub emisją promieniowania elektromagnetycznego w różnych zakresach:
- nadfiolet (UV) 200-380 nm,
- promieniowanie widzialne (Vis) 380-780 nm,
- bliska podczerwień (IR) 0,78-30000 μ
Podstawowe pojęcia i prawa związane ze spektrofotometrią
Punkt izozbestyczny
To punkt odpowiadający określonej długości fali powstały z przecięcia się krzywych wykreślonych w układzie absorbancja – długość fali, w którym obie formy związku w roztworze (zdysocjowana i niezdysocjowana) mają jednakową absorpcję. Zmiana pH nie zmienia położenia, związek może posiadać wiele takich punktów.
Widmo absorpcyjne związku chemicznego
Widmo to jest miarą ilości światła zaabsorbowanego przez ten związek od długości fali świetlnej (λ). Jeżeli na próbkę pada promieniowanie elektromagnetyczne (światło) o natężeniu I0 to część tego promieniowania zostanie zaabsorbowana, a część przechodzi przez tą próbkę. Rejestrując natężenia promieniowania padającego (I0) i przechodzącego (It) możemy wyznaczyć ilość światła, która ulega pochłonięciu przez roztwór (absorbancja, A), lub która przez niego przeszła (trasmitancja, T).
Absorbancja
Wielkością, która opisuje zjawisko absorpcji, jest absorbancja. To bezwymiarowa miara intensywności promieniowania elektromagnetycznego w stosunku do ilości wolnych atomów. Ta wielkość została wprowadzona w celu ułatwienia obliczeń związanych z wielkością absorpcji. Absorpcją nazywamy oddziaływanie pomiędzy promieniowaniem elektromagnetycznym a materią – pochłanianie części energii przez materię. Absorbancja jest addytywna, a czasami nazywa się ją gęstością optyczną. Symbolicznie zapisuje się ją jako Abs lub A. Matematycznie jest logarytmem dziesiętnym stosunku natężenia wiązki promieniowania padającego na badaną próbkę (I0) do natężenia wiązki promieniowania przechodzącego przez badaną próbkę (It). Może przyjmować wartości od 0 do nieskończoności. Wyrażenie matematyczne, opisujące tą zależność nazywa się Prawem Lamberta-Beera. Absorbancja przy danej długości fali zależy od współczynnika absorpcji (ε), grubości warstwy absorbującej (zwykle 1 cm) i stężenia badanego roztworu.
Transmitancja
Inaczej nazywana również przepuszczalnością, to stosunek natężenia promieniowania przechodzącego przez próbkę (It) do natężenia promieniowania padającego na próbkę (I0), które jest równe natężeniu promieniowania przechodzącego przez odnośnik. Najczęściej wyrażana jest w procentach i może znajdować się w przedziale od 0% do 100%. Wyrażamy ją wzorem:
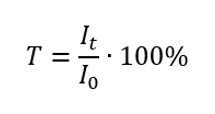
Zależność między absorbancją a transmitancją wyrażają poniższe zależności:
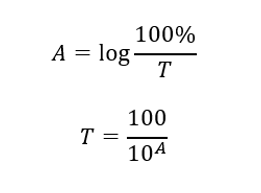
Prawo Lamberta
Mówi o tym, że absorbancja jest proporcjonalna do grubości warstwy absorbującej jednorodnej próbki. Możemy je zapisać jako iloraz współczynnika absorpcji (k) oraz grubości mierzonej warstwy próbki (l):
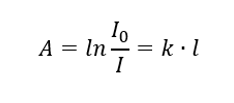

Prawo Lamberta-Beera
Dotyczy absorpcji promieniowania przez roztwory i można je sformułować następująco: jeżeli współczynnik absorpcji rozpuszczalnika jest równy zeru, to absorbancja wiązki promieniowania monochromatycznego przechodzącej przez jednorodny roztworów jest wprost proporcjonalna do stężenia (c) roztworu i do grubości warstwy absorbującej (l). Prawo Lamberta-Beera jest definicją absorbancji i można je zapisać następująco:
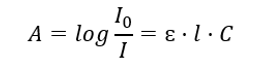
Molowy współczynnik absorpcji (ɛ) jest wartością charakterystyczną dla danej substancji w konkretnym rozpuszczalniku i przy określonej długości fali. Jest proporcjonalny do prawdopodobieństwa przejść pomiędzy poziomami energetycznymi cząsteczki i bezpośrednio zależy od energii fotonów promieniowania. Liczbowo przedstawia absorbancję, którą wykazuje roztwór o stężeniu 1 mol/dm3, przy grubości warstwy absorbującej równej 1 cm. Znajomość współczynnika pozwala na wyznaczenie stężenia badanego roztworu po zmierzeniu wielkości absorbancji. Opcjonalnie można również wyliczyć na podstawie współczynnika oraz stężenia spodziewaną absorbancję roztworu. Głównym wykorzystaniem wzoru jest wyznaczenie stężenia substancji o znanej wartości molowego współczynnika absorpcji oraz zmierzonej empirycznie absorbancji. Można to zrobić, korzystając ze wzoru lub wyznaczając krzywą wzorcową, sporządzoną dla danej substancji w kilku punktach w zakresie spodziewanego stężenia. Prawo Lamberta-Beera możemy bowiem przedstawić również jako zależność absorpcji od stężenia: A = f(C).
Prawo addytywności
Prawo Lamberta-Beera odnosi się do przypadku, gdy w roztworze znajduje się jedna substancja absorbująca. Jeżeli jednak w roztworze wieloskładnikowym jest więcej substancji, które absorbują promieniowanie przy wybranej długości fali, to absorbancja tego roztworu (A) jest równa sumie absorbancji jego poszczególnych składników (A1, A2,…), tzn. A=A1+A2+⋯+An. Warto zaznaczyć i pamiętać o tym, że absorbancja każdego ze składników jest iloczynem jego stężenia oraz odpowiadającego mu molowego współczynnika absorpcji. Jest to III prawo absorpcji, stosowane w spektrofotometrycznej analizie układów wieloskładnikowych.
Odstępstwa od praw absorpcji
Warunkiem spełnienia praw absorpcji jest monochromatyczność działającego na układ promieniowania oraz jego niezbyt wysokie natężenie. Powodem odstępstw od prawa Lamberta-Beera mogą być:
- niedoskonałość przyrządów pomiarowych, co powoduje brak spełnienia warunku,
- reakcje chemiczne zachodzące w trakcie pomiaru, na przykład polimeryzacja, hydroliza, kondensacja,
- mętność roztworu.
Zastosowanie elektronowych widm absorpcyjnych
- Pozwala ustalić typ przejść elektronowych, badając widma w rozpuszczalnikach o różnej polarności.
- Różnice w położeniu i natężeniu pasm absorpcyjnych różnych form cząsteczkowych wykorzystywane są do badania równowag jakie się ustalają między nimi w roztworach (badania strukturalne, równowagi tautomeryczne).
- Wykorzystywane do oznaczania zawartości związków na podstawie prawa Lamberta-Beera.
- Stosowane jako dodatkowa metoda identyfikacji na podstawie położenia λmax badanych substancji.
- Znajdują zastosowanie przy oznaczaniu czystości badanych związków – przesunięcie położenia maksimum absorpcji, porównanie stosunku wartości absorbancji w dwóch różnych punktach widma.

Spektroskopia elektronowa UV-Vis
Dla zjawiska absorpcji szczególnie ciekawą techniką jest spektrofotometria UV-Vis pozwalająca na analizę jakościową i ilościową wielu substancji. Zjawisko absorpcji promieniowania wykorzystuje się gdy: absorpcja zależy liniowo od stężenia lub gdy absorpcja jest addytywna, tzn. dla roztworu wieloskładnikowego jest sumą absorpcji jego składników. Warunki są spełnione gdy nie występują w układzie oddziaływania międzycząsteczkowe.
Analizując widma absorpcyjne UV-Vis powstałe w wyniku przejścia promieniowania elektromagnetycznego przez roztwór obserwuje się przejścia elektronów walencyjnych ze stanu podstawowego do wzbudzonego. Takie zjawisko skutkuje pochłanianiem (absorpcją) części promieniowania przy pewnych długościach fali. Absorbowanie jest następstwem przejścia tych elektronów na wyższe poziomy energetyczne, jednak aby do tego doprowadzić, kwanty promieniowania elektromagnetycznego muszą posiadać na tyle dużą ilość energii, aby zrównoważyć różnicę energii pomiędzy poziomami energetycznymi. W cząsteczkach takie energie wynoszą kilka elektronowoltów, co odpowiada właśnie częstotliwości promieniowania UV-Vis.
Chromofory
Związki, które wykazują absorpcję w zakresie UV-Vis posiadają w swojej strukturze chromofory, czyli takie grupy atomów, których elektrony charakteryzują się niskimi energiami wzbudzenia. Inaczej chromofor to część cząsteczki (grupa atomów) odpowiedzialna za selektywną absorpcję promieniowana z zakresu widzialnego (180-800 nm), a tym samym za występowanie barwy. Zaliczamy do nich: pierścienie aromatyczne (aromatyczny sekstet elektronów), wiązania wielokrotne (ich część – wiązania typu π), zarówno między atomami węgla jak i inne, np. grupy karbonylowej C=O.
Auksochromy
Inną grupą atomów są auksochromy, czyli podstawniki, które nie wykazują absorpcji w zakresie promieniowania UV-Vis, jednak ich obecność powoduje zmiany w widmach absorbujących elementów. Wzmacniają one działanie chromoforów, co często możemy zaobserwować w postaci znacznie intensywniejszego zabarwienia badanej substancji niż w przypadku ich braku w układzie. Ponadto dzielimy auksochromy na batochromy, np. –NH2, -OH, które przesuwają maksimum absorpcji w kierunku fal dłuższych oraz hipsochromy, takie jak –CH3, -CO, które przesuwają maksimum w kierunku fal krótszych.
Atomowa Spektrometria Absorpcyjna ASA
To kolejna technika wykorzystująca zjawisko absorpcji. Z jej zastosowaniem oznacza się pierwiastki chemiczne w postaci próbek w każdym stanie (ciekłym, stałym, gazowym), a sam pomiar polega na obserwacji absorpcji promieniowania o specyficznej długości fali przez swobodne atomy metali. Podstawą techniki jest fakt, iż atom może absorbować promieniowanie elektromagnetyczne tylko o takiej długości fali, przy której może je również emitować i jest ono charakterystyczne tylko dla danego pierwiastka. Im wyższa energia jest dostarczana do atomu, tym elektrony są wzbudzane na wyższe poziomy i tym większą liczbę linii obserwujemy w widmie. Jeśli dostarczona energia odpowiada potencjałowi jonizacji atomu, tworzą się jony np. Na+. Podstawą analizy ilościowej metodą atomowej spektrometrii absorpcyjnej jest proporcjonalność absorbancji do ilości absorbujących atomów i prawo Lamberta-Beera.