Stechiometria to dział chemii ogólnej, zajmujący się obliczeniami dotyczącymi ilościowego przebiegu reakcji chemicznych. W trakcie pracy w laboratorium bardzo często niezbędna jest wiedza na temat tego, ile (masy, objętości, cząsteczek) substratów musimy użyć, aby przeprowadzana przez nas reakcja chemiczna zaszła całkowicie lub aby otrzymać założoną przez nas ilość produktu. Czasami konieczne jest również obliczenie nadmiaru lub niedomiaru substratu, który spowodował inny niż zakładany przebieg doświadczenia. Każde z tych obliczeń wynika bezpośrednio z ilościowej interpretacji zapisu równania reakcji chemicznej oraz wykorzystuje prawa zachowania masy. Tego typu równania nazywa się obliczeniami stechiometrycznymi.

Co musimy wiedzieć?
W celu korzystania ze stechiometrii konieczna jest wiedza w wielu obszarach, m.in.: równania reakcji chemicznych, współczynniki stechiometryczne, mole i masy molowe oraz objętości molowe gazów i prawo Avogadra. Korzystając z wiedzy na temat stechiometrii reakcji chemicznych, można rozwiązać wiele problemów obliczeniowych, takich jak:
- analiza elementarna,
- obliczenia molowe,
- obliczenia masowe,
- obliczenia mieszanin niestechiometrycznych z umożliwieniem wyznaczenia substancji limitującej reakcję,
- wydajność reakcji.
Masa molowa
Ze względu na niewyobrażalnie małą masę pojedynczych atomów i cząsteczek powstał unit (u), czyli jednostka wyrażająca masę atomową. W praktyce jest to wartość, równa 1/12 masy izotopu węgla 12C. Ta porcja substancji jest ściśle powiązana ze stałą Avogadra i wyznacza się ją jako liczbę gramów substancji, która zawiera 6,022·1023 atomów, cząsteczek lub jonów. Masa molowa [M] jest liczbowo równa masie atomowej lub cząsteczkowej, a jednostką jest g/mol.
Molowa objętość substancji [Vm]
To wielkość charakterystyczna dla danej substancji, która silnie zależy od warunków temperaturowych i ciśnieniowych. To objętość danej substancji, którą zajmuje jej jeden mol. W warunkach normalnych przyjmuje się stałą wartość równą 22,4 dm3.
Prawo stałości składu oraz zachowania masy
Każdy związek chemiczny niezależnie od jego pochodzenia oraz metody otrzymywania ma swój ściśle określony i stały skład jakościowy, a także ilościowy. Na przykład tlenek siarki (IV), zawsze zawiera 50% masowych siarki, a tlenek siarki (VI) 40% mas. tego pierwiastka. W układzie zamkniętym masa powstałych produktów jest równa masie substratów zużytych podczas reakcji. Prawo zachowania masy ma swoje odzwierciedlenie w konieczności bilansowania każdego równania reakcji chemicznej z użyciem odpowiednich współczynników chemicznych tak, aby obie strony równania były sobie równe pod względem ilości obecnych atomów. Współczynniki stechiometryczne odzwierciedlają molowe stosunki ilości reagentów występujących w rozważanej reakcji chemicznej.
Równanie reakcji chemicznej
Wszystkie potrzebne informacje na temat zachodzących stosunkowo zależności pomiędzy substancjami chemicznymi wynikają z ich równania reakcji chemicznej. Można odczytać z niego kilka ważnych stosunkowych i ilościowych informacji.
Przykład 1.
Z równania syntezy amoniaku, która przebiega według reakcji:
![]()
możemy przeprowadzić kilka interpretacji – cząsteczkową, molową, w masach molowych, w objętościach molowych oraz w liczbach cząsteczek.
a) Pod względem cząsteczkowym możemy odczytać, że trzy cząsteczki wodoru reagują z jedną cząsteczką azotu, tworząc dwie cząsteczki amoniaku.
b) Oznacza to również, że trzy mole wodoru wchodzą w reakcję z jednym molem azotu, tworząc produkt w postaci dwóch moli amoniaku.
c) Korzystając z układu okresowego pierwiastków chemicznych, zawierającego masy molowe poszczególnych atomów, możemy również stwierdzić na podstawie równania, że 6 g wodoru przereagowało całkowicie z 28 g azotu tworząc 34 g amoniaku.
d) Następnie zakładając warunki normalne, wiemy, że jeden mol gazu zajmuje 22,4 dm3. Dzięki temu możemy stwierdzić, że 67,2 dm3 wodoru reagują z 22,4 dm3 azotu tworząc 44,8 dm3
e) Kolejną przydatną zależnością jest prawo Avogadra mówiące o tym, że w jednakowych objętościach różnych gazów, w tych samych warunkach ciśnienia i temperatury znajduje się taka sama liczba cząstek. Znając stałą Avogadra równą 6,0221023, wiemy, że w celu przeprowadzenia całkowitej reakcji chemicznej syntezy amoniaku potrzebujemy 3·6,022·1023 cząsteczek wodoru oraz 6,022·1023 cząsteczek azotu. W wyniku reakcji otrzymujemy 2·6,022·1023 cząsteczek amoniaku.
Przykład 2.
Reakcja spalania magnezu w chlorze zachodząca zgodnie z równaniem:
![]()
pozwala nam wysnuć interpretacje podobne do poprzedniego przykładu.
a) Już na pierwszy rzut oka przedstawione równanie pozwala nam na wniosek, iż w celu otrzymania jednej cząsteczki chlorku magnezu musimy dostarczyć w roli substratów jedną cząsteczkę magnezu oraz jedną cząsteczkę chloru.
b) Jest to oczywiście równoznaczne z ilością obecnych w układzie moli, tzn. jeden mol magnezu, jeden mol chloru, jeden mol chlorku magnezu.
c) W przypadku obliczeń masowych wiemy, że 24 g magnezu reagują z 71 g chloru tworząc 95 g chlorku magnezu.
d) Ponieważ w rozważanej reakcji chemicznej bierze udział wyłącznie jeden gaz – chlor, dla niego możemy również zapisać, że zajmuje objętość 22,4 dm3.
e) W liczbach cząsteczek każdy składnik jest sobie równy i przyjmuje wartość 6,0221023.
Wydajność procentowa reakcji chemicznej [%W]
Obliczeń stechiometrycznych używa się również w celu poznania wydajności reakcji, czyli stosunku rzeczywistej ilości otrzymanego produktu do ilości wynikającej z równania reakcji chemicznej.
Przykład 1.
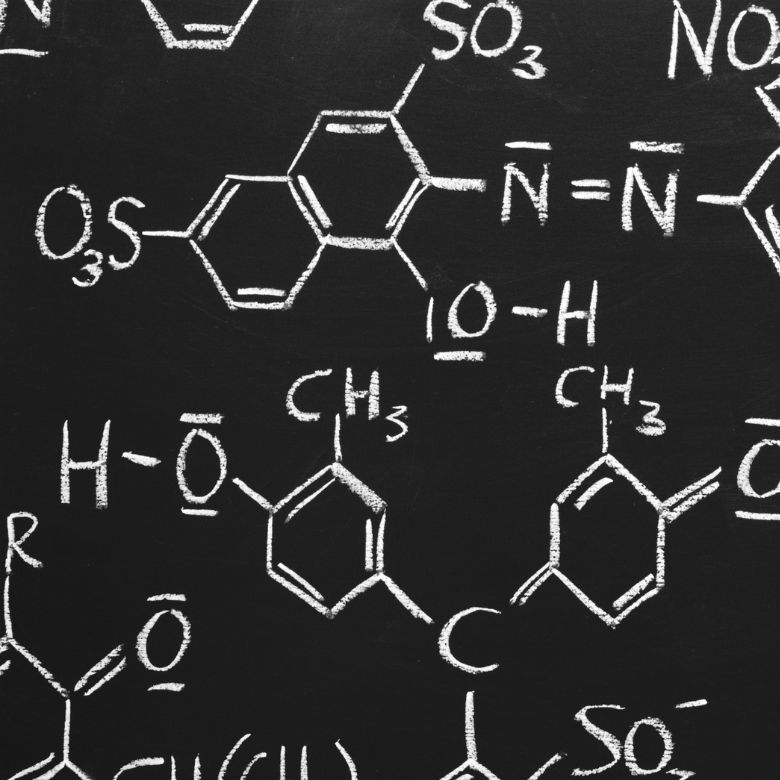
Przeprowadzono reakcję utleniania 30 kg tlenku siarki(IV) i w obecności katalizatora platynowego otrzymano produkt w postaci 34 kg tlenku siarki(VI). Z jaką wydajnością przebiegł proces?
Równanie reakcji chemicznej:
![]()
Z zapisanej reakcji możemy zauważyć, że z dwóch moli tlenku siarki(IV) powstaje taka sama ilość moli tlenku siarki(VI). Znając masy molowe reagentów, wiemy że stechiometrycznie przy założeniu 100% wydajności, ze 128 g SO2 powstaje 160g SO3. Dzięki temu możemy ułożyć proporcję:
0,128 kg SO2 – 0,160 kg SO3
30 kg SO2 – x kg SO3
Stąd dowiemy się, jaka jest ilość tlenku siarki(VI), która powstałaby przy stuprocentowej wydajności.
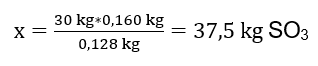
Znając teoretyczną oraz rzeczywistą ilość SO3 możemy obliczyć wydajność, z jaką zaszła interesująca nas reakcja.
37,5 kg SO3 – 100% wydajności
34 kg SO3 – x% wydajności
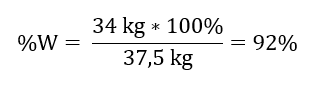
Proces utleniania tlenku siarki(IV) do tlenku siarki(VI) przy użyciu katalizatora platynowego zaszedł z 92% wydajnością.
Wzory rzeczywiste i elementarne
Kolejnym zastosowaniem obliczeń stechiometrycznych jest ustalanie wzorów prostych związków chemicznych. Wzór rzeczywisty to sumaryczny wzór związku chemicznego, który jest identyczny lub stanowi całkowitą wielokrotność wzoru empirycznego. Jeżeli wiemy, że wzór ogólny związku chemicznego to NxOy, to wartości indeksów stechiometrycznych można obliczyć poprzez dzielenie masy przypadającej na atomy przez ich masy atomowe. Jeżeli nie znamy masy cząsteczkowej związku chemicznego, a jedynie jego skład procentowy, możliwe jest podanie wyłącznie wzoru elementarnego. Może być on prawdziwym odzwierciedleniem wzoru sumarycznego lub jedynie wyznaczać stosunek poszczególnych pierwiastków.
Przykład 1.
Masa cząsteczkowa związku chemicznego wynosi 92 u i składa się on w 30,43% z azotu oraz w 69,57% z tlenu. Jaki jest wzór rzeczywisty rozważanego związku chemicznego?
Ponieważ sumaryczna wartość występujących w związku cząsteczek wynosi 100% możemy przyjąć, że:
92 u – 100%
Dzięki temu możemy wyliczyć poszczególne zawartości pierwiastków:
92 u – 100%
x u azotu – 30,43%
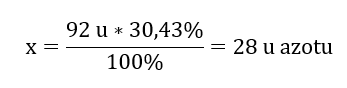
Stąd wiemy, że masa przypadająca na atomy tlenu to:
92 u – 28 u = 64 u
Znając poszczególne masy pierwiastków, możemy wyznaczyć indeksy stechiometryczne:
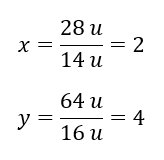
Wzór rzeczywisty tego związku chemicznego to N2O4.
Przykład 2.
W związku chemicznym występują dwa pierwiastki – tlen w ilości 60% oraz 40% siarki. Jaki jest jego wzór elementarny?
Wzór ogólny to SxOy, gdzie x stanowi 40% a y 60%. Znając masy molowe poszczególnych pierwiastków, możemy to przedstawić w sposób następujący:
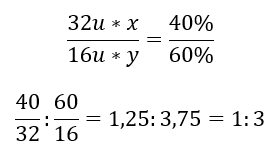
Oznacza to, że w danym związku chemicznym na jeden atom siarki przypadają trzy atomy tlenu. Wzór elementarny ma postać SO3.

Nadmiar i substrat limitujący
W przypadku reakcji, w których reagenty występują w stosunku rozbieżnym od odpowiadającej im stechiometrii, jeden z nich przereaguje całkowicie i nastąpi zatrzymanie reakcji. Występuje on wtedy w postaci reagentu limitującego, natomiast drugi z nich będzie w układzie w nadmiarze, a po zakończeniu reakcji nadal będzie się w nim znajdował również w postaci pierwotnej.
Przykład 1.
W laboratorium przeprowadzono reakcję 40 cm3 0,25 M roztworu siarczanu(VI) glinu z 50 cm3 0,5 M roztworu chlorku baru. Ile powstanie gramów osadu?
Równanie reakcji chemicznej:
![]()
Pierwszym krokiem do poznania rzeczywistego przebiegu reakcji jest wyznaczenie rzeczywistej liczby moli substancji biorących udział w danej reakcji.
nAl2(SO4)2: C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm3 = 0,010 mol
nBaCl2: C BaCl2 · V BaCl2 = 0,5 · 0,05 dm3 = 0,025 mol
Drugim krokiem jest wyznaczenie substratu występującego w niedomiarze na podstawie stechiometrii reakcji – to on będzie warunkował ilość powstającego osadu.
1mol Al2(SO4)3 – 3mol BaCl2
0,010 mol Al2(SO4)3 – x mol BaCl2
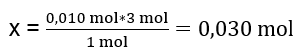
W celu przeprowadzenia reakcji całkowicie, mając 0,010mol Al2(SO4)3 konieczne jest dodanie do układu 0,030mol BaCl2. Chlorku baru reaguje jednak wyłącznie 0,025mol co oznacza, że jest on w niedomiarze i będzie limitował reakcję. Dlatego ilość osadu powstałą w reakcji należy obliczyć na podstawie ilości tego substratu.
Ilość moli użytego chlorku baru zgodnie ze stechiometrią reakcji jest równa z ilością moli powstającego osadu, a więc:
nBaSO4 = nBaCl2
0,025mol BaSO4 = 0,025mol BaCl2
Znając liczbę moli siarczanu(VI) baru możemy obliczyć jego masę:
mBaSO4 = nBaSO4 · MBaSO4
mBaSO4 = 0,025mol · 233,393 g/mol = 5,835g
W wyniku podanych w zadaniu reakcji oraz ilości substratów, powstaje 5,835g osadu siarczanu(VI) baru.