Roztworem nazywamy jednorodną mieszaninę co najmniej dwóch substancji. Pomimo tego, że roztwór kojarzy nam się głównie z cieczami, roztworami nazywamy również mieszaniny gazowe oraz stałe. Nie mniej jednak bardzo duża część reakcji chemicznych zarówno na skalę laboratoryjną, jak i przemysłową zachodzi w środowisku wodnym. Możemy mieć do czynienia z trzema typami ciekłych roztworów – rozpuszczalnik zawsze jest ciekły, jednak substancja rozpuszczona może być gazem, cieczą lub ciałem stałym. Dla przykładu są to wodne roztwory chlorowodoru, etanolu i soli.

Wyrażanie składu roztworu
Najważniejszą cechą każdego roztworu jest zdefiniowanie jego składu. Umiejętność wyznaczania składu roztworu oraz przeliczania go w zależności od interesujących nas jednostek jest podstawową umiejętnością każdego chemika. Ilość danego składnika obecnego w mieszaninie może być zdefiniowana na różne sposoby na przykład masowo, objętościowo lub molowo. Z tego względu istnieje również kilka typów stężeń, będących zależnością ilości składnika od ilości roztworu bądź mieszaniny. Najczęściej opisując składy roztworów, posługujemy się terminami: ułamek masowy, ułamek objętościowy, ułamek molowy oraz stężenie molowe. Ułamki sugerują nam, jaką część danej mieszaniny stanowi interesujący nas składnik. Mogą być wyrażone w jednostkach masy, objętości lub w molach związku.
Stężenie molowe
Jest najczęściej wybieranym stężeniem, ze względu na wygodę operowania nim na podstawie określenia ilości moli substancji zawartej w objętości roztworu. Podstawą teoretyczną jest stwierdzenie, że roztwory dwóch różnych substancji, które posiadają takie samo stężenie i objętość, znajdując się w tej samej temperaturze, zawierają taką samą liczbę moli, a więc również jednakową liczbę cząsteczek substancji rozpuszczonej. Dzięki tej zależności możliwe jest, dla roztworów o równych stężeniach molowych w celu osiągnięcia właściwej proporcji liczby moli wyznaczonej przez współczynniki stechiometryczne, zmieszanie odpowiedniej objętości roztworów. Oznacza to, że jeżeli rozważamy reakcję typu A + B → C, gdzie jeden mol substancji A reaguje z jednym molem substancji B, aby reakcja przebiegła całkowicie musimy zmieszać jednakowe objętości obu roztworów o tym samym stężeniu molowym. W przypadku kiedy jest to reakcja typu A + 2B → C, czyli jeden mol substancji A reaguje z dwoma molami substancji B, należałoby zmieszać jedną objętość roztworu A z dwiema objętościami roztworu B. W takim przypadku jest również inne rozwiązanie, gdyż zamiast użycia równomolowych roztworów w stosunku objętościowym 1:2 można użyć jednej objętości roztworu A oraz jednej objętości roztworu B o stężeniu dwukrotnie wyższym. Stężenie molowe, oznaczane symbolem Cm określa liczbę moli substancji zawartych w jednostce objętościowej, najczęściej w 1 dm3 roztworu.
Wzór pozwalający na obliczenie stężenia molowego jest ilorazem ilości moli substancji (ns) oraz całkowitej objętości roztworu (Vr) wyrażonej w dm3:
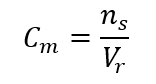
Stosując jednostkę podstawową objętości według układu SI, czyli metr sześcienny należy jednostkę ilości substancji wyrażać w kilomolach. Nie stanowi to jednak większych problemów obliczeniowych, gdyż 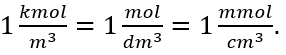 .
.
Jednostką stężenia molowego Cm jest mol na decymetr sześcienny, co w uproszczeniu często zapisuje się symbolem M.
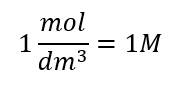

Zastosowanie stężenia molowego
a) Obliczanie stężenia molowego na podstawie zawartości składnika w roztworze
Przykład 1. Roztwór zawiera 30g wodorotlenku potasu w 3,0 dm3 roztworu. Oblicz jego stężenie molowe.
Krok 1. Obliczenie masy molowej KOH
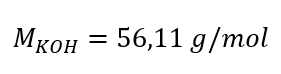
Krok 2. Obliczenie liczby moli KOH, znajdującej się w roztworze
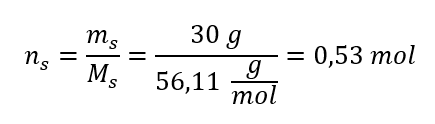
Krok 3. Obliczenie stężenia molowego z wykorzystaniem wzoru
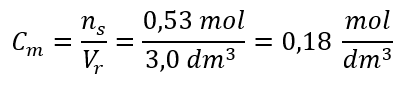
Odpowiedź: Roztwór wodorotlenku potasu, zawierający 30 g substancji w 3,0 dm3 roztworu ma stężenie molowe 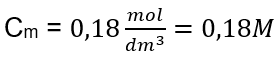
b) Sporządzanie roztworu o zadanym stężeniu
Przykład 2. Obliczyć masę glukozy o wzorze C6H12O6 potrzebną do sporządzenia 300 cm3 o stężeniu 0,32 mol/dm3.
Krok 1. Obliczenie masy molowej glukozy
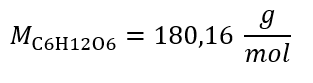
Krok 2. Obliczenie masy potrzebnej glukozy z wykorzystaniem przekształconego wzoru na stężenie molowe wiedząc, że :
Dzięki obliczeniom wiemy, że w celu sporządzenia takiego roztworu należy odważyć 17,30 g glukozy i przenieść ją ilościowo do kolby miarowej o pojemności 300 cm3.
Odpowiedź: Do sporządzenia 300 cm3 roztworu glukozy o stężeniu molowym
0,32 mol/ dm3 należy odważyć 17,30 g substancji.
c) Rozcieńczanie i zatężanie stężonych roztworów
Z użyciem stężenia molowego możemy również sporządzić roztwór o zadanym stężeniu (Cm2) poprzez rozcieńczenie stężonego roztworu (Cm1), gdzie:
W trakcie rozcieńczania zmienia się wyłącznie objętość roztworu, liczba moli substancji rozpuszczonej jest taka sama. Można więc przyjąć, że:
Przekształcając wzór na stężenie molowe, otrzymujemy zależności:
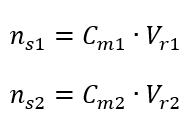
Wiedząc, że otrzymujemy równanie:
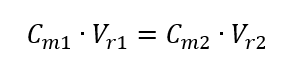
Wzór na rozcieńczanie roztworów, uwzględniając stężenie molowe, w tym nowo otrzymane (Cmx) można więc zapisać jako:
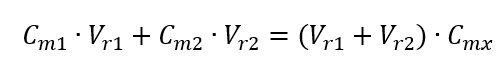
Przykład 3. Jaką objętość 0,150 mol/dm3 kwasu można otrzymać, rozcieńczając wodą 250 cm3 0,750 mol/dm3 roztworu tego kwasu?
Krok 1. Przekształcenie wzoru przy założeniu, że stężenie wody wynosi Cm2 = 0 mol/dm3.
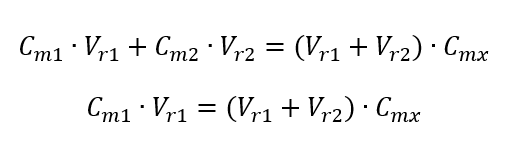
Krok 2. Obliczenie sumarycznej objętości (Vx)
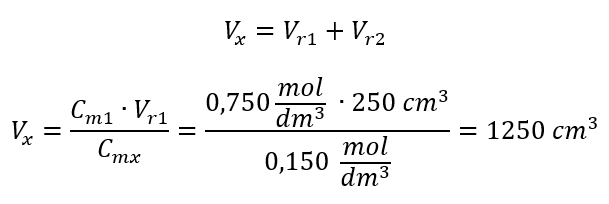
Alternatywnie można wykorzystać zależność stałości liczby moli podczas rozcieńczania:
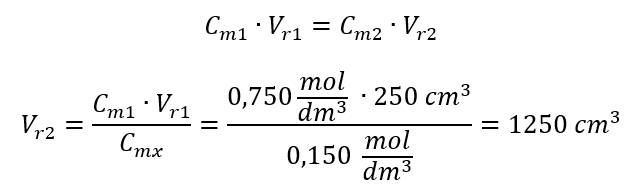
Odpowiedź: Aby rozcieńczyć kwas do wymaganego stężenia, należy użyć 1,25 dm3 wody.
Przykład 4. Oblicz, ile wody należy odparować z 300 cm3 roztworu o stężeniu 0,125 mol/dm3, aby otrzymać roztwór o stężeniu 1,50 mol/dm3.
Krok 1. Przekształcenie wzoru na zmianę stężenia molowego przy założeniu, że stężenie molowe wody Cm2 = 0 mol/dm3.
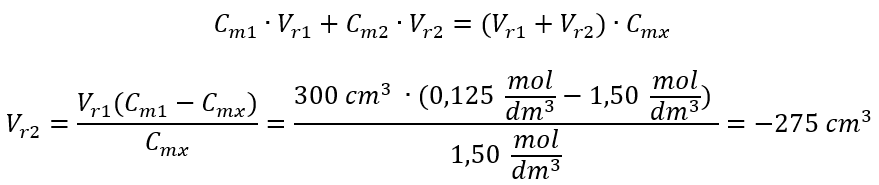
Odpowiedź. W celu zatężenia roztworu należy odparować 275
Przeliczanie stężenia molowego względem stężenia procentowego
W codziennej pracy w laboratorium konieczne jest przeliczanie różnych stężeń roztworów. Najczęściej stosuje się właśnie stężenia molowe oraz procentowe. Możliwe jest przechodzenie pomiędzy nimi z wykorzystaniem gęstości roztworu. Konieczne jest wprowadzenie jej do wzorów na interesujące nas stężenia:
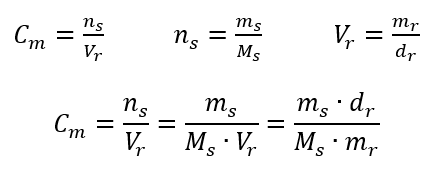
W przekształceniu możemy zauważyć stosunek masy substancji do masy roztworu, który jest podstawą stężenia procentowego, wyrażanego wzorem:
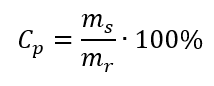
Podstawiając wzór na stężenie procentowe do przekształconego wcześniej wzoru na stężenie molowe, otrzymujemy zależność, dzięki której możemy swobodnie przechodzić pomiędzy nimi:
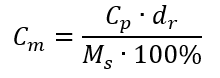
Jedynym ograniczeniem wzoru jest zastosowanie odpowiednich jednostek, a więc warto za każdym razem podczas obliczeń je uwzględniać.
Przykład 5. Oblicz stężenie molowe kwasu siarkowego (VI) wiedząc, że jego stężenie procentowe wynosi Cp = 98,0%, a gęstość d = 1,84 kg/dm3.
Zadanie można obliczyć na dwa sposoby:
Sposób 1. W kilku krokach, bez użycia wzoru
Krok 1. Obliczenie masy 1,00 dm3 kwasu
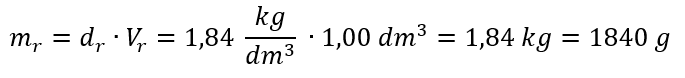
Krok 2. Obliczenie masy kwasu z uwzględnieniem stężenia procentowego
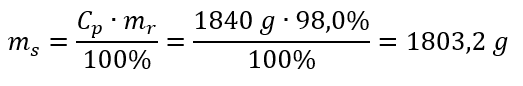
Krok 3. Obliczenie liczby moli
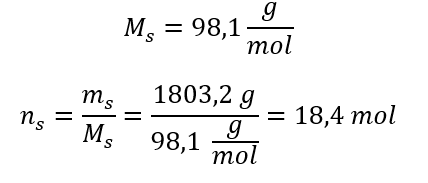
Krok 4. Obliczenie stężenia molowego wiedząc, że jest ono ilością moli substancji w 1 dm3 roztworu
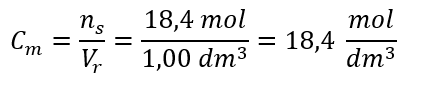
Sposób 2. Wykorzystanie zależności pomiędzy stężeniem procentowym i molowym
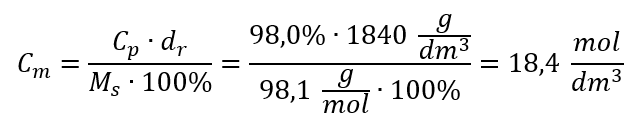
Odpowiedź: Stężenie molowe tego kwasu wynosi 18,4 mol/dm3.