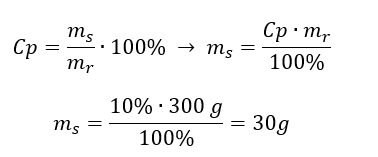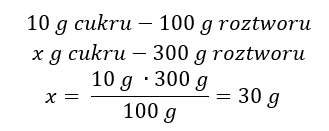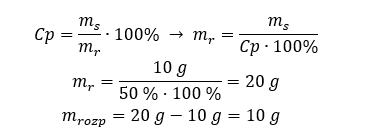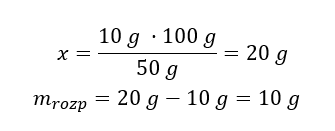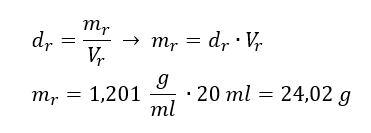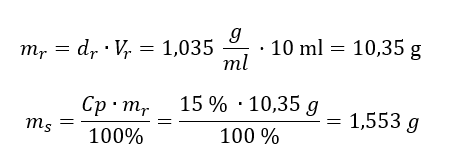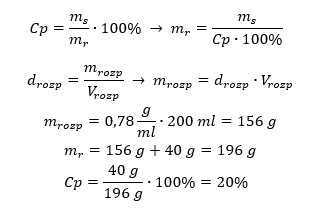Kwasy, wodorotlenki czy też sole, to tylko niektóre związki zaliczane do grupy nieorganicznych. Co jeszcze kryje chemia nieorganiczna? Jakie pojęcia są związane z tą dziedziną chemii? Informacje na ten temat znajdziesz w tej sekcji!
Produkty
Surowce chemiczne
Kosmetyki i detergenty
Agrochemikalia
Czyszczenie i mycie
Energia i Zasoby
Izolacje natryskowe
Kleje i uszczelniacze
Powłoki i tusze
Pożarnictwo
Środek pianotwórczy do zastosowań gaśniczych
Przemysł budowlany

Budownictwo drogowe

Ceramika budowlana

Dodatki do betonu i zapraw

Izolacja przewodów i kabli

Izolacja rurociągów

Kleje i spoiwa budowlane

Kotwy chemiczne

Natryskowe izolacje termiczne i akustyczne

Otuliny

Panele warstwowe

Piany montażowe typu OCF

Pozostałe aplikacje

Przemysł drzewny

Płyty gipsowo-kartonowe i dodatki do gipsu

Płyty izolacyjne

Rury preizolowane

Systemy izolacji na bazie płyt PU

Wiercenie i tunelowanie
Przemysł celulozowo-papierniczy
Przykładowe funkcje produktów
Przemysł elektroniczny i elektryczny
Przemysł farmaceutyczny
Przemysł meblarski
Przemysł spożywczy
Tekstylia i skóry
Transport
Tworzywa sztuczne i gumy
Środki smarowe i płyny obróbcze
INCI & CAS
Surfaktanty
Poliuretany
Produkty konsumenckie