To grupa związków nieorganicznych, powstałych z połączenia różnych pierwiastków z tlenem, o ogólnym wzorze XnOm, gdzie „X” to dowolny pierwiastek, „O” to tlen, zawsze na drugim stopniu utlenienia, a litery „n,m” w indeksie dolnym to współczynniki. Przykładami tlenków są woda H2O, tlenek potasu K2O, tlenek glinu Al2O3, tlenek wapnia CaO oraz tlenek węgla(II) CO.

Podział tlenków
Tlenki możemy podzielić ze względu na kilka kategorii. Najbardziej ogólny podział to rozróżnienie na tlenki metali na przykład litu, magnezu, glinu, żelaza oraz tlenki niemetali w tym tlenki węgla, azotu, siarki i chloru. Inne kryterium to podział ze względu na ich stan skupienia. Ciałami stałymi są prawie wszystkie tlenki metali oraz część niemetali (SiO2, P4O10), cieczami są woda, tlenek siarki(VI) oraz tlenek manganu(VII), a tlenkami gazowymi są przede wszystkim tlenki niemetali takie jak CO, CO2, SO2, NO i NO2. Tlenki możemy również podzielić ze względu na występujący w nich rodzaj wiązania. W tlenku magnezu MgO, tlenku wapnia CaO czy tlenku sodu Na2O występują jony O2- oraz wiązania jonowe, stąd ich nazwa – tlenki jonowe. Inną grupą są tlenki kowalencyjne na przykład tlenek węgla (II) CO, tlenek azotu (II) NO czy też tlenek siarki (IV) SO2, w których wiązanie pomiędzy atomem tlenu a pierwiastkiem przyjmuje charakter wiązania kowalencyjnego spolaryzowanego.
Charakter chemiczny tlenków
Najciekawszym dla chemików podziałem jest ten ze względu na charakter chemiczny tlenków. Rozróżniamy cztery główne kategorie – tlenki kwasowe, zasadowe, obojętne i amfoteryczne.
- Tlenki kwasowe, czasami nazywane również bezwodnikami kwasowymi, rozróżniamy po tym, że reagują z zasadami, dając produkt w postaci soli. Znaczna część tlenków kwasowych po rozpuszczeniu w wodzie tworzy odpowiednie roztwory kwasów tlenowych. Dzieje się tak między innymi z tlenkiem siarki (IV), który rozpuszczając się w wodzie wytwarza kwas siarkowy (IV) oraz tlenkiem chromu (VI) rozpuszczanym do kwasu chromowego (VI):
SO2 + H2O → H2SO3
CrO3 + H2O → H2CrO4
Istnieje niewielka grupa tlenków kwasowych, które są nierozpuszczalne w wodzie. Są jednak rozpuszczalne w roztworach mocnych zasad, a należą do nich tlenek krzemu (IV) SiO2, tlenek molibdenu (VI) MoO3 oraz tlenek wolframu(VI) WO3. Ich reakcje z zasadami potwierdzają kwasowy charakter:
SiO2 + 2NaOH → Na2SiO3 + H2O
MoO3 + 2KOH → K2MoO4 + H2O
WO3 + 2NaOH → Na2WO4 + H2O
Z reguły tlenki kwasowe stanowią tlenki niemetali oraz tlenki metali na ich najwyższych możliwych stopniach utlenienia. W przypadkach kiedy dany pierwiastek tworzy kilka tlenków na różnych stopniach utlenienia tak jak np. chrom, wraz ze wzrostem stopnia utlenienia, właściwości kwasowe tworzonych przez niego tlenków również rosną:
- tlenek chromu(II) CrO posiada charakter zasadowy,
- tlenek chromu(III) Cr2O3 posiada właściwości amfoteryczne,
- tlenek chromu(VI) CrO3 posiada charakter kwasowy.

- Tlenki zasadowe to takie związki tlenu z metalami, które reagują z kwasami, dając produkty w postaci odpowiednich soli. Część z nich, to znaczy tlenki wytworzone z pierwiastkami z grupy pierwszej i drugiej układu okresowego, z wyłączeniem berylu, charakteryzuje również reakcja z wodą skutkująca wytworzeniem zasadowych wodorotlenków. Dzieje się tak na przykład podczas reakcji tlenków sodu, litu oraz baru z wodą:
Na2O + H2O → 2NaOH
Li2O + H2O → 2LiOH
BaO + H2O → Ba(OH)2
Istnieją również tlenki zasadowe, które nie rozpuszczają się w wodzie a jedynie w roztworach kwasów. Należą do nich między innymi tlenek manganu(II) oraz tlenek żelaza(II):
MnO + H2SO4 → MnSO4 + H2O
FeO + 2HCl → FeCl2 + H2O
- Tlenki obojętne są najmniej reaktywną grupą tlenków. Nie zachodzą z nimi reakcje ani z użyciem kwasów, ani zasad. Są również nierozpuszczalne w wodzie. Przedstawicielami tej grupy tlenków są tlenek węgla(II) CO oraz tlenek azotu(II) NO.
- Tlenki amfoteryczne są całkowitym przeciwieństwem tlenków obojętnych i wykazują jednocześnie charakter kwasowy oraz zasadowy. Oznacza to, że reagują zarówno z mocnymi zasadami, jak i kwasami. Produktami takich reakcji są zawsze sole, a pierwiastek będący początkowo w połączeniu z tlenem przekształca się w odpowiedni kation lub anion reszty kwasowej. Jedynym podobieństwem do tlenków obojętnych jest ich słaba rozpuszczalność w wodzie. Przykładami tlenków o charakterze amfoterycznym są tlenek berylu BeO, tlenek glinu Al2O3, wspomniany już wcześniej tlenek chromu(III), tlenek cyny(II) SnO, tlenek ołowiu(II) PbO oraz tlenek cynku ZnO. Reagując z roztworami wodnymi mocnych zasad, na przykład z wodnym roztworem wodorotlenku sodu, tworzą sole kompleksowe. W ich resztach kwasowych obecne są atomy lub jony metalu, który pochodzi z tlenku, skompleksowane z odpowiednią ilością grupy hydroksylowych. Ich liczba jest zależna od liczby koordynacyjnej, która charakteryzuje dany pierwiastek. Przykładowo, atomy pochodzące od tlenków typu MO (M – metal), czyli takich jak tlenek berylu BeO wykazują liczbę koordynacyjną równą 4. Atomy pochodzące od tlenków typu M2O3, na przykład Al2O3 mogą przyjmować dwie różne liczby koordynacyjne, w zależności od warunków reakcji jest to 4 lub 6. Przykładowe reakcje tlenków amfoterycznych:
BeO + 2HCl → BeCl2 + H2O
BeO + 2NaOH + H2O → Na2[Be(OH)4] tetrahydroksyocynkan sodu
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2KOH + 3H2O → 2K[Al(OH)4] tetrahydroksyoglinian potasu
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6] heksahydroksyoglinian sodu
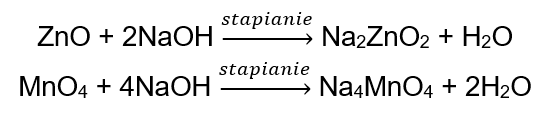
Niektóre tlenki, takie jak tlenek cynku oraz tlenek manganu (IV) wykazują dość specyficzne właściwości amfoteryczne. Ten drugi, ani w warunkach normalnych ani standardowych nie reaguje z żadnymi zasadami. Oba natomiast reagują z nimi w wyniku stapiania ze stałymi zasadami, na przykład:

Otrzymywanie tlenków
- Bezpośrednia synteza pierwiastków:
a) synteza atomów siarki i tlenu z otrzymaniem tlenku siarki (IV)
S + O → SO2
b) synteza atomów magnezu i tlenu z otrzymaniem tlenku magnezu
2Mg + O2 → 2MgO
c) synteza atomów węgla i tlenu z otrzymaniem tlenku węgla (IV)
C + O2 → CO2 - Rozkład termiczny soli, wodorotlenków i tlenków:
a) rozkład węglanu wapnia na tlenek wapnia i tlenek węgla (IV)
CaCO3 → CaO + CO2
b) rozkład wodorotlenku miedzi (II) na tlenek miedzi (II) i wodę
Cu(OH)2 → CuO + H2O
c) rozkład tlenku manganu(IV) na tlenek manganu (III) i tlen
4MnO2 → 2Mn2O3 + O2 - Utlenianie tlenków na niższych stopniach utlenienia, ze zwiększeniem ich wartościowości:
a) utlenianie tlenku siarki (IV) do tlenku siarki (VI)
2SO2 + O2 → 2SO3
b) utlenianie tlenku azotu (II) do tlenku azotu (IV)
2NO + O2 → 2NO2
c) utlenianie tlenku węgla (II) do tlenku węgla (IV)
2CO + O2 → 2CO2
- Redukcja tlenków na wyższych stopniach utlenienia, ze zmniejszeniem ich wartościowości:
a) redukcja tlenku węgla (IV) do tlenku węgla (II)
CO2 + C → 2CO
b) redukcja tlenku cyny (II) do tlenku cyny (I)
2SnO + O2 → 2SnO2 - Spalanie związków organicznych:
a) spalanie metanu w tlenie z otrzymaniem tlenku węgla (IV) i wody
CH4 + 2O2 → CO2 + 2H2O
b) spalanie amoniaku w tlenie z otrzymaniem tlenku azotu (II) i wody
4NH3 + 5O2 → 4NO + 6H2O - Reakcja nietrwałych kwasów tlenowych:
a) rozkład kwasu węglowego (IV) na tlenek węgla (IV) i wodę:
H2CO3 → CO2 + H2O
b) rozkład kwasu siarkowego (IV) na tlenek siarki (IV) i wodę:
H2SO3 → SO2 + H2O