Elektroujemność to wielkość, która odzwierciedla tendencję danego atomu znajdującego się w cząsteczce do przyciągania ku sobie elektronów. A w praktyce jest to zdolność atomu lub grup funkcyjnych do przyciągania gęstości elektronowej do siebie. Najczęściej używaną skalą związaną z tą wielkością jest ta wprowadzona przez Linusa Paulinga, dzięki której w łatwy sposób można obliczyć przybliżony charakter wiązania.

Charakterystyka elektroujemności
Cząsteczki homojądrowe, na przykład H2 i O2 posiadają w orbitalach molekularnych równe sobie współczynniki cA i cB, które można zapisać funkcjami falowymi:
Ψ+AB = cAΨA + cBΨB
Ψ−AB = cAΨA − cBΨB
W takim przypadku orbital charakteryzuje się symetrycznym w stosunku do środka cząsteczki kształtem, a jego ładunek elektryczny jest tak samo symetrycznie w nim rozłożony. Innym przykładem są jednak cząsteczki heterojądrowe, w których praktycznie niemożliwe jest zachowanie równych współczynników, a także ich pełnej symetrii w stosunku do środka cząsteczki. W momencie, gdy poziom energetyczny orbitalu atomowego ΨB jest niższy od poziomu energetycznego orbitalu atomowego ΨA, zachodzi zależność , a maksimum gęstości prawdopodobieństwa napotkania elektronu jest przesunięte w kierunku atomu B. W praktyce powoduje to przesunięcie uwspólnionej w wiązaniu chemicznym pary elektronowej, czyli polaryzację w kierunku atomu B. Przykładowo, w cząsteczce wodorku litu LiH to przesunięcie jest skierowane w stronę atomu wodoru, natomiast w cząsteczce fluorku wodoru HF w kierunku atomu fluoru. Oznacza to, że atom wodoru ma niższy poziom energetyczny od litu, jednak wyższy od fluoru (przeczytaj o fluorowcach). W takich warunkach jeden z atomów obu cząsteczek przyjmuje ładunek ujemny oznaczany jako –δ, a drugi jest dodatni +δ. Wzór ogólny takiej cząsteczki to A+δB-δ.
Ładunki atomów
Wspomniany wcześniej ładunek δ może przyjmować różne wartości w zależności od pierwiastków związanych wiązaniem chemicznym. Jego wartość równa 0 oznacza, że para elektronowa rozkłada swój ładunek symetrycznie i całkowicie lokalizuje się w pobliżu atomu o niższym poziomie energetycznym, co skutkuje przeniesieniem obu elektronów do tego atomu. W ten sposób wytwarza się wiązanie jonowe pomiędzy pierwiastkami. W znacznej większości wiązań chemicznych występują jednak ułamkowe wartości ładunków, co skutkuje staniem pomiędzy wiązaniem kowalencyjnym a jonowym.
Moment dipolowy
Dipol to cząsteczka, w której możliwe są do rozróżnienia dwa bieguny – dodatni oraz ujemny. Moment dipolowy oznaczany symbolem μ jest natomiast miarą wielkości przesunięcia w niej ładunku elektrycznego. Definiuje się go w postaci iloczynu bezwzględnej wartości ładunku elektrycznego (δ), zawartego w jednym z biegunów, oraz odległości od tych biegunów (l):
μ = δ · l
Ładunek dodatni (δ+) oraz ujemny (δ-) nazywamy ładunkiem cząstkowym i przypisujemy jego lokalizację na konkretnym atomie, jednak w rzeczywistości jest to wyłącznie większe lub mniejsze prawdopodobieństwo występowania elektronu wokół ich jąder. Takie zjawisko jest czasami mylone z procesami utleniania i redukcji, ale w przeciwieństwie do zachodzących wtedy zmian, przyjmowanie takich ładunków przez atomy nie powoduje ich przejścia na inny stopień utlenienia, a więc nie dochodzi do wymiany elektronu pomiędzy nimi. Jednostką wyrażającą moment dipolowy w układzie SI jest kulombometr (C·m). Najczęściej jednak w obliczeniach wykorzystuje się jego jednostkę zapisaną w układzie CGS, czyli debaj (D). Jeden debaj odpowiada wartości 3,33564·10-30 C·m. Największy możliwy teoretycznie moment dipolowy charakteryzuje cząsteczki o wiązaniu czysto jonowym. Najmniejszy natomiast występuje w cząsteczkach, których wiązanie ma charakter czysto kowalencyjny – moment dipolowy jest w takim przypadku równy zeru. Najwięcej jest jednak przypadków pośrednich, w których występują zróżnicowane charaktery cząsteczek.
Moment dipolowy fluorowcowodorów
Kilka zależności pomiędzy elektroujemnością a momentem dipolowym można łatwo zauważyć na konkretnych związkach chemicznych.
Tabela 1 Momenty dipolowe fluorowcowodorów
| Związek | Moment dipolowy wyznaczony eksperymentalnie [μ, D] | Długość wiązania [pm] | Iloczyn ładunku elementarnego i długości dipola [e·l, D] | Udział charakteru jonowego [%] | Różnica elektroujemności fluorowca i wodoru |
| HF | 1,98 | 92 | 4,42 | 45 | 1,9 |
| HCl | 1,08 | 128 | 6,15 | 18 | 0,9 |
| HBr | 0,79 | 143 | 6,87 | 12 | 0,7 |
| HI | 0,38 | 162 | 7,78 | 5 | 0,4 |
Stosunek μ/(e·l’), czyli rzeczywistego momentu dipolowego do momentu dipolowego, który odpowiada wiązaniu jonowemu, może stanowić miarę odstępstw od całkowicie kowalencyjnego charakteru wiązania. Iloczyn tej zależności w postaci (μ/(e·l’))·100% stanowi procentowy udział charakteru jonowego w rozważanym wiązaniu. Jest to wyłącznie przybliżona wartość, gdyż moment dipolowy zależy nie tylko od polarności wiązania, ale również od zachowania wolnych par elektronowych. Zdarza się, że chmura elektronowa może być przesunięta na zewnątrz cząsteczki, co w konsekwencji sprawia, że równanie służące do wyznaczenia jej momentu dipolowego ma dodatkowy człon. W przypadku cząsteczki amoniaku chmura jest skierowana zgodnie z momentem dipolowym wiązania, co skutkuje wzrostem wypadkowego momentu dipolowego. Przeciwnie jest natomiast w przypadku cząsteczki tlenku węgla, w którym chmura jest skierowana przeciwnie i w efekcie zmniejsza wypadkowy moment dipolowy.

Elektroujemność
To bezwymiarowa wielkość empiryczna, która odzwierciedla tendencję danego atomu znajdującego się w cząsteczce do przyciągania ku sobie elektronów. A w praktyce jest to zdolność atomu lub grup funkcyjnych do przyciągania gęstości elektronowej do siebie. Najczęściej używaną skalą związaną z tą wielkością jest ta wprowadzona przez Linusa Paulinga, dzięki której w łatwy sposób można obliczyć przybliżony charakter wiązania. Uczony w celu obliczenia elektroujemności poszczególnych pierwiastków zastosował następującą metodę:
Przyjmujemy, że DA-A i DB-B to energie wiązań w cząsteczkach dwuatomowych (A2, B2). Energię wiązania, które występuje w cząsteczce oznaczamy jako DA-B. Empirycznie wykazano, że jeżeli takie wiązanie zawiera niewielki udział charakteru jonowego, bądź nie zawiera go wcale, to różnica pomiędzy wartościami DA-B a średnią geometryczną wartości energii DA-A i DB-B jest równa lub bliska zeru. W przypadku kiedy wiązanie A-B ma wyraźne odstępstwa od charakteru kowalencyjnego, ta różnica przyjmuje wartości dodatnie, które rosną wraz ze wzrostem udziału jonowego charakteru. Różnica pomiędzy elektroujemnością (x) dwóch atomów biorących udział w wiązaniu wyrażana jest wzorem:
![]()
Stąd, jeżeli Pauling w swoich obliczeniach przyjmował elektroujemność fluoru równą 4,0, to możliwe jest obliczenie kolejnych elektroujemności pierwiastków. Jeżeli znamy wartość xA atomów pierwiastka A oraz wartość współczynnika Δ’ to możemy obliczyć wartość xB przy pomocy powyższego równania. Skala Paulinga jest skonstruowana w taki sposób, że jej wartości zgadzają się w przybliżeniu z wartościami momentu dipolowego wiązania utworzonego przez rozważane atomy, co możemy zobaczyć na przykładzie w Tabeli 1, zawierającej wartości wyznaczone dla fluorowcowodorów. Oprócz opisanej skali istnieje jeszcze kilka opisanych w literaturze naukowej, w tym elektroujemności opisane przez:
- Mullikena, który w swojej pracy przyjął, że elektroujemność pierwiastka jest wprost proporcjonalna do sumy jego powinowactwa elektronowego i energii jonizacji. Powinowactwo elektronowe, czyli ilość energii, która jest wydzielana wskutek przyłączenia elektronu do obojętnego atomu oraz energia jonizacji równa ilości energii koniecznej do oderwania elektronu od obojętnego atomu. Największe elektroujemności charakteryzują więc atomy, które wykazują duże powinowactwo elektronowe oraz wysoką energię jonizacji.
- Allreda i Rochowa, którzy założyli proporcjonalność elektroujemności do miary siły, z jaką jądro atomowe (Z) działa na elektrony walencyjne, zapisywanej w postaci
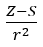 (r – promień atomowy, S – stała ekranowa). Zgodnie z ich teorią, elektroujemność (x) pierwiastków można obliczyć przy użyciu wzoru:
(r – promień atomowy, S – stała ekranowa). Zgodnie z ich teorią, elektroujemność (x) pierwiastków można obliczyć przy użyciu wzoru:
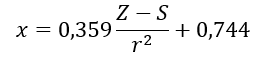
W każdej skali elektroujemność wodoru jest zbliżona do wartości 2.2, a inne wartości nieco się różnią. Przykłady elektroujemności atomów pierwiastków obliczone według skali Paulinga, Mullikena oraz Allreda i Rochowa zostały przedstawione w poniższej Tabeli 2.
Tabela 2 Elektroujemności przykładowych pierwiastków w skali Paulinga (P), Mullikena (M) oraz Allreda i Rochowa (AR)
| Atom | P | M | AR |
| F | 3,98 | 3,90 | 4,10 |
| O | 3,44 | 3,04 | 3,50 |
| N | 3,04 | 2,28 | 3,07 |
| Cl | 3,16 | 2,95 | 2,83 |
| C | 2,55 | 1,75 | 2,50 |
| H | 2,20 | 2,21 | 2,20 |
| Si | 1,90 | 2,25 | 1,74 |
| K | 0,82 | 0,77 | 0,91 |
| Rb | 0,82 | 0,50 | 0,89 |
| Cs | 0,79 | – | 0,86 |
| Fr | 0,70 | – | 0,86 |
Pomimo rozbieżności w obliczeniach trzema metodami, w każdej skali najwyższą elektroujemnością charakteryzuje się fluor, następnie są tlen, azot i chlor. Najmniejsze wartości zostały wyznaczone dla fransu, cezu, rubidu i potasu. Pierwiastki, które są typowymi niemetalami, posiadają elektroujemności powyżej wartości 2, typowe metale – poniżej 2. Standardową wielkością jest wspomniana wcześniej elektroujemność wodoru równa w przybliżeniu 2,2.

Elektroujemność w układzie okresowym
Podobnie jak wiele innych właściwości, elektroujemność również ma swoje odzwierciedlenie w ułożeniu pierwiastków chemicznych w układzie okresowym. W grupie elektroujemność maleje wraz ze wzrostem ilości powłok oraz charakteru metalicznego, a więc rośnie w kierunku od fransu do wodoru. W okresie elektroujemność wzrasta wraz ze wzrostem obecnych elektronów walencyjnych i spadkiem charakteru niemetalicznego, a więc od metali do gazów szlachetnych.
Elektroujemność a typ wiązania – podsumowanie
Znając poszczególne wartości elektroujemności pierwiastków, które tworzą wiązanie chemiczne, możemy wywnioskować jego charakter. Jeżeli ich różnica wynosi pomiędzy 0,0 a 0,4, to wiązanie ma charakter kowalencyjny. W przypadku, gdy ta różnica wynosi od 0,4 do 1,7, to wiązanie jest kowalencyjne spolaryzowane. Powyżej wartości 1,7 na różnicy elektroujemności pierwiastków możemy się spodziewać wystąpienia wiązania jonowego.