A energia das reações químicas é um dos elementos importantes que nos permitem entender as transformações que ocorrem em uma reação química. Durante essa transformação, são produzidos compostos químicos com estrutura e composição química diferentes das matérias-primas de que são feitos. No decorrer de uma reação química, as ligações existentes entre os átomos das moléculas utilizadas como reagentes são quebradas e novas ligações são produzidas – presentes nos produtos.

O sistema e o ambiente de uma reação química
Para a interpretação adequada de uma reação química em termos de energia, precisamos ter alguns conhecimentos sobre o seguinte:
- Sistema: uma área separada de matéria com limites claros. O tipo de sistema é importante: é aberto se a reação envolver a troca de energia e matéria, fechado se a reação envolver apenas a troca de energia, ou isolado se não houver troca de energia ou matéria.
- Ambiente: tudo o que não está incluído no sistema, mas está localizado nas proximidades.
- Componentes do sistema: todas as substâncias que estão localizadas no sistema analisado e possuem suas propriedades químicas características.
A energia das ligações químicas
O efeito de energia que caracteriza qualquer reação química é o resultado de mudanças que ocorrem durante a quebra e produção de novas ligações entre os átomos. O fato é que cada quebra de uma ligação química está intrinsecamente ligada à absorção de uma quantidade adequada de energia, enquanto a formação de uma nova ligação provoca a produção de energia. A liberação de energia para o meio ambiente pode ter diferentes efeitos: calor, luz, trabalho ou eletricidade. Cada um desses processos é um fator componente que afeta a mudança geral na energia interna do sistema no qual a reação ocorre. É importante que, independentemente de os reagentes consumirem ou cederem energia durante a transformação, uma certa quantidade de energia seja sempre necessária para iniciar todo o processo.
A primeira lei da termodinâmica
A primeira regra importante sobre a energia das reações químicas é a relação formulada na primeira lei da termodinâmica, afirmando que a energia interna de um sistema que apenas troca energia com o ambiente (um sistema fechado) só pode ser transformada em calor ou trabalho. Isso se reflete na equação de Helmholtz: ∆U = Q + W Onde ΔU denota a mudança na energia interna, Q denota calor e W denota trabalho. Podemos perceber pela fórmula que a energia interna de um sistema isolado, ou seja, que não troca energia ou massa com o meio ambiente, é constante. Os componentes da energia interna são todas as energias cinéticas dos átomos, íons, moléculas, elétrons e componentes do núcleo atômico, que estão atualmente no sistema de reação, bem como as energias de suas interações, ou seja, as energias das ligações químicas, interações entre cargas, e assim por diante. Observe que a energia interna não contém energia cinética ou potencial do sistema como um todo. A soma das energias cinética e potencial do sistema como um todo e a energia interna é a energia total do sistema (E).
Entalpia do sistema (H)
Esse é outro conceito importante relacionado à energia das reações químicas, que na prática significa a soma da energia interna do sistema e o produto de sua pressão e volume. Em termos qualitativos, é a energia necessária para produzir um sistema no vácuo (U), acrescida de trabalho, ou seja, o quociente de pressão e volume (pV), que o sistema deve realizar contra forças externas para atingir um volume diferente de zero. A relação que define a entalpia de um sistema é expressa da seguinte forma: H = U + pV Uma reação ocorrendo em tal sistema causa uma variação infinitamente pequena na entalpia: dH = dU + dpV + pdV Se as condições de reação são isobáricas, então se a pressão durante o processo não muda, a segunda parte pode ser omitida, pois dpV=0. Após substituir diferenciais por incrementos definidos e após substituir a expressão referente à variação da energia interna do sistema, obtém-se a seguinte relação: ∆H = Q + W + p∆V Supondo que o processo analisado realiza um trabalho volumétrico a pressão constante , então W = -pΔV, e conseqüentemente: ∆H = Q – p∆V + p∆V Segue-se da equação que, se a reação ocorre a uma pressão constante, então a mudança na entalpia do sistema é igual ao calor: ∆H = Q
Capacidades energéticas de uma reação
Com base na fórmula derivada acima, que indica que a variação da entalpia do sistema pode ser igual ao calor da reação, os processos são classificados de acordo com as transformações térmicas. Em termos da direção do fluxo de energia, dividimos as reações químicas em:
- Reações exotérmicas, que são aquelas reações onde podemos observar a emissão de energia, por exemplo na forma de calor, para o ambiente do sistema. Isso acontece quando a soma das entalpias dos produtos é menor que a soma das entalpias dos substratos, portanto quando ΔH<0.
- Reações endotérmicas, portanto, reações químicas que causam a absorção de energia do ambiente. Uma condição para tal reação é fornecer uma quantidade apropriada dessa energia. Isso se aplica a todas as transformações para as quais a entalpia total dos produtos é maior que a entalpia total dos substratos, portanto ΔH>0.
Notações de reações químicas
Considerando as reações químicas juntamente com sua demanda e distribuição de energia, seus efeitos de calor específico são incluídos na notação de uma equação química. Para reações exotérmicas, o valor absoluto do efeito térmico existente é anotado no lado do produto. Por outro lado, ao anotar uma reação endotérmica, o valor absoluto da energia absorvida é anotado no lado do substrato. Para dar um exemplo:
- Reação exotérmica:
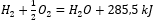
- Reação endotérmica: 2H 3 PO 4 + 3Mg(OH) 2 + 407kJ = Mg 3 (PO 4 ) 2 + 6H 2 O
Outra maneira é anotar uma equação química junto com o valor do efeito de energia dado de lado. Nesse caso, o valor que representa a energia de uma reação exoenergética é negativo, enquanto é positivo para uma reação endoenergética. Por exemplo:
- Reação exoenergética: Fe + S → FeS ∆H= -95,2 kJ/mol
- Reação endoenergética: FeS → Fe + S ∆H= 95,2 kJ/mol
lei de Hess
Constitui uma base para cálculos termoquímicos, afirmando que o efeito do calor é sempre o mesmo, independentemente da forma como a reação é realizada. Isso nos permite calcular a entalpia padrão de uma reação (Δ r H ϴ ), assumindo o uso de condições padrão, ou seja, uma pressão de 10 5 Pa e qualquer temperatura. Como a entalpia é uma função de estado, sua variabilidade depende apenas de dois valores: nos estados inicial e final, que em uma reação química representam o estado dos substratos e o estado dos produtos, respectivamente. A lei de Hess é expressa por uma equação que contém coeficientes estequiométricos (v) e entalpias molares padrão de formação (Δ f H ϴ ): 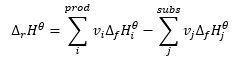
Entalpia molar padrão de formação
É uma entalpia obtida pela formação de 1 mol de um determinado composto químico a partir de elementos em seus estados básicos. O estado básico é a variante mais durável do elemento em condições específicas. Para dar um exemplo, o grafite é a variante mais durável do carbono a 25 o C e 10 5 Pa. Por outro lado, em alta temperatura e pressão, uma forma estável de carbono é o diamante. Para cada reagente que participa de uma reação em sua condição básica, o valor da entalpia molar padrão de formação é zero. Normalmente, são átomos individuais de gases nobres ou as variantes mais duráveis de outros gases em condições específicas. Para uma pressão padrão (10 5 Pa) e temperatura (normalmente 25 o C), os valores das entalpias molares padrão de formação dos compostos são reunidos em tabelas químicas. A unidade desse valor é . A lei de Hess aplicada às reações químicas implica que o valor da entalpia da reação é independente do número de reações intermediárias. A única informação importante é que substratos específicos são usados para obter produtos específicos.
A síntese de dióxido de carbono
A síntese de dióxido de carbono pode ser realizada de várias maneiras, mas de acordo com a lei de Hess, cada uma delas leva ao mesmo valor de variação nas entalpias padrão.
- síntese direta
- A síntese de óxido de carbono (II) + oxidação do composto em óxido de carbono (IV)
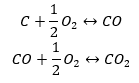 Ao lermos os valores das entalpias padrão de formação dos compostos da tabela e substituí-los nas equações químicas, veremos que a entalpia para cada método é a mesma: -393,5 kJ/mol.
Ao lermos os valores das entalpias padrão de formação dos compostos da tabela e substituí-los nas equações químicas, veremos que a entalpia para cada método é a mesma: -393,5 kJ/mol.
lei de Kirchhoff
Ele nos permite transformar os cálculos para calcular a entalpia padrão de uma reação para uma determinada temperatura, se soubermos seu valor em uma temperatura diferente. Também conhecemos as relações entre o calor molar de todos os reagentes e a temperatura. A lei pode ser aplicada, pois a variação da entalpia da reação depende das condições em que foi determinada: ela varia junto com a mudança de temperatura e pressão. A derivação da fórmula deve ser iniciada definindo a capacidade térmica, ou seja, a razão entre o calor fornecido e o aumento da temperatura: ![]() Assumindo condições isotérmicas, podemos fazer a seguinte transformação:
Assumindo condições isotérmicas, podemos fazer a seguinte transformação: ![]() A integração da equação resultante e a conversão da capacidade térmica na parte que representa a mudança na capacidade térmica padrão é refletida pela equação fornecida pela lei de Kirchhoff:
A integração da equação resultante e a conversão da capacidade térmica na parte que representa a mudança na capacidade térmica padrão é refletida pela equação fornecida pela lei de Kirchhoff: 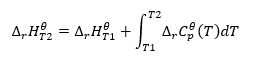 Para condições padrão, a mudança na capacidade térmica de uma reação é definida pela equação com as variáveis v, sendo fatores estequiométricos, e , que representa o calor molar padrão de um dado reagente. Quando a diferença de temperatura é pequena (até 100K), assume-se que o valor do calor molar padrão do reagente é constante dentro de uma certa faixa. Então podemos usar a forma simplificada da lei de Kirchhoff, assumindo que as capacidades térmicas dos reagentes não dependem da temperatura, mas sim da pressão constante, :
Para condições padrão, a mudança na capacidade térmica de uma reação é definida pela equação com as variáveis v, sendo fatores estequiométricos, e , que representa o calor molar padrão de um dado reagente. Quando a diferença de temperatura é pequena (até 100K), assume-se que o valor do calor molar padrão do reagente é constante dentro de uma certa faixa. Então podemos usar a forma simplificada da lei de Kirchhoff, assumindo que as capacidades térmicas dos reagentes não dependem da temperatura, mas sim da pressão constante, : ![]()
