A escala de pH é utilizada para determinar o grau de acidez ou alcalinidade de uma solução em uma escala quantitativa que contém os números absolutos de 0 a 14. Baseia-se na atividade molar dos íons hidrônio [H 3 O +] no líquido testado. A escala foi desenvolvida em 1909 pelo bioquímico dinamarquês S. Sorensen, e as letras 'p' e 'H' representam, respectivamente, o latim 'potentio' (potência) e o átomo de hidrogênio, que é denotado na tabela periódica como 'H' (hidrogênio). A escala de pH reflete tanto um quanto o outro: para determinar o nível de pH, usamos o expoente de potência com um sinal alterado para nos referirmos aos prótons que contêm hidrogênio. O nível de pH de qualquer solução produzida é uma de suas características químicas mais importantes e um fator que determina o curso e a velocidade de muitas reações químicas, bem como o tipo de substâncias produzidas.

Diferenciação na escala
A escala de pH inclui quinze graus, onde o valor médio (7) indica um pH neutro. As soluções posicionadas próximas de 0 são chamadas de ácidos fortes, enquanto as do lado oposto, próximas de 14, são chamadas de bases fortes. Um pH ácido significa que a solução contém muitos íons de hidrogênio [H 3 O +], e um pH básico significa que há muitos íons de hidróxido [OH –]. A escala de pH é mais frequentemente referida no contexto de soluções, mas o potencial químico absoluto de um próton o torna aplicável em todos os estados de agregação. Isso nos permite comparar diretamente o nível de alcalinidade de praticamente qualquer substância.
Autodissociação da água
Para entender completamente o sentido da escala de pH, precisamos da reação espontânea de autodissociação da água, que ocorre de acordo com a seguinte equação:  É um processo reversível cuja constante de equilíbrio é deslocada para o lado esquerdo da equação, ou seja, para a água não dissociada.
É um processo reversível cuja constante de equilíbrio é deslocada para o lado esquerdo da equação, ou seja, para a água não dissociada.
Como calcular o nível de pH?
Apesar da suposição inicial erroneamente definida de que a determinação diz respeito à concentração de íons de hidrogênio [H +], a fórmula mais popular ainda é a seguinte:  Hoje já sabemos que as soluções não contêm íons de hidrogênio aquoso, ou seja, prótons presentes na água, devido ao processo imediato de solvatação. O fenômeno resulta na falta de prótons livres e na presença de íons hidrônio [H 3 O +], que é causado pela reação espontânea e irreversível:
Hoje já sabemos que as soluções não contêm íons de hidrogênio aquoso, ou seja, prótons presentes na água, devido ao processo imediato de solvatação. O fenômeno resulta na falta de prótons livres e na presença de íons hidrônio [H 3 O +], que é causado pela reação espontânea e irreversível: 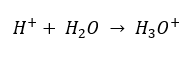 Portanto, a notação correta da fórmula é a seguinte:
Portanto, a notação correta da fórmula é a seguinte: 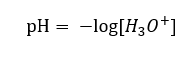
Ambiente indicado na escala de pH
Supõe-se que a concentração de íons hidrônio na água pura à temperatura ambiente (25 o C) seja de 10 -7 mol/dm 3 , portanto seu nível de pH pode ser calculado da seguinte forma: 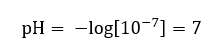 Isso está de acordo com o fato de que a água, por ser neutra, está posicionada no meio da escala, o que indica a inércia química da substância. Também prova que a água contém um número igual de ânions hidróxido e cátions hidrônio. Em ácidos e bases, no entanto, esse equilíbrio é perturbado. Um expoente negativo sugere uma relação onde quanto menor o nível de pH, maior o poder da solução testada. O termo ‘potência’ no contexto da escala de pH refere-se ao fato de que o valor 0 é considerado por ácidos fortes e irritantes, enquanto o valor 14 se refere às substâncias alcalinas mais fortes.
Isso está de acordo com o fato de que a água, por ser neutra, está posicionada no meio da escala, o que indica a inércia química da substância. Também prova que a água contém um número igual de ânions hidróxido e cátions hidrônio. Em ácidos e bases, no entanto, esse equilíbrio é perturbado. Um expoente negativo sugere uma relação onde quanto menor o nível de pH, maior o poder da solução testada. O termo ‘potência’ no contexto da escala de pH refere-se ao fato de que o valor 0 é considerado por ácidos fortes e irritantes, enquanto o valor 14 se refere às substâncias alcalinas mais fortes.
A adição de ácido na água
Uma mudança de pH de um nível neutro pode ser causada pela adição de substâncias de diferentes poderes. Por exemplo, se adicionarmos um dos ácidos mais fortes ( ácido clorídrico, HCl ) à água, isso fará com que o ácido se dissocie de acordo com a seguinte reação:  Ao contrário da autodissociação da água, o equilíbrio da dissociação ácida é significativamente deslocado para a direita. Portanto, se esse ácido for dissolvido em água ambientalmente inerte, aumentará a quantidade de íons hidrônio presentes na água e, consequentemente, aumentará sua atividade molar. Para dar um exemplo, de acordo com a reação de dissociação, ácido clorídrico concentrado a 1 mol/dm 3 introduz na solução íons hidrônio concentrados a 1 mol/dm 3 . O nível de pH para tal solução de ácido clorídrico pode ser calculado com base na seguinte fórmula:
Ao contrário da autodissociação da água, o equilíbrio da dissociação ácida é significativamente deslocado para a direita. Portanto, se esse ácido for dissolvido em água ambientalmente inerte, aumentará a quantidade de íons hidrônio presentes na água e, consequentemente, aumentará sua atividade molar. Para dar um exemplo, de acordo com a reação de dissociação, ácido clorídrico concentrado a 1 mol/dm 3 introduz na solução íons hidrônio concentrados a 1 mol/dm 3 . O nível de pH para tal solução de ácido clorídrico pode ser calculado com base na seguinte fórmula: 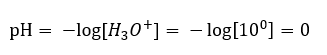
A adição de uma base na água
No caso oposto, onde adicionamos uma base forte na água, a concentração de íons hidrônio cairá. Por exemplo, o hidróxido de sódio concentrado a 1 mol/dm 3 terá, analogamente, a mesma concentração mas de outros íons (íons hidróxido), conforme a reação que sofre sob a influência da água:  Nesse caso, é possível calcular indiretamente o pH usando a seguinte fórmula suplementar de pOH:
Nesse caso, é possível calcular indiretamente o pH usando a seguinte fórmula suplementar de pOH: 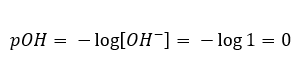 Se sabemos que:
Se sabemos que: 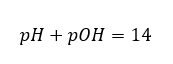 podemos facilmente calcular que o pH da solução de uma base forte (NaOH) concentrada a 1 mol/dm 3 tem um pH de 14.
podemos facilmente calcular que o pH da solução de uma base forte (NaOH) concentrada a 1 mol/dm 3 tem um pH de 14. 
O nível de pH fora da escala?
Como a escala de pH foi originalmente desenvolvida para fins de soluções diluídas, é possível que ácidos ou bases fortes a excedam, indo abaixo de 0 ou acima de 14. Isso ocorre porque a escala é inútil para altas concentrações onde o pH não é mais logarítmico função dos íons hidrônio [H 3 O +]. Então usamos valores diferentes, que surgem de equilíbrios constantes da dissociação de ácidos e bases.
Métodos para determinar o valor de pH da solução
Para determinar empiricamente o pH de um ambiente, utilizamos os chamados indicadores ácido-base. Na prática, são substâncias que mudam de cor quando afetadas por diferentes condições de pH. Existem três tipos de tais indicadores:
- Indicadores que mudam de cor em um ambiente básico, por exemplo:
- a fenolftaleína incolor torna-se cor de framboesa,
- timolftaleína incolor torna-se azul.
- Indicadores que mudam de cor em meio ácido, por exemplo:
- laranja de metila muda sua cor de laranja para vermelho,
- O azul de bromotimol muda sua cor de azul para amarelo.
- Indicadores universais, por exemplo:
- azul de bromotimol torna-se amarelo em ácidos e azul em bases,
- lacmus fica vermelho em ácidos ou azul em bases.
Também é comum embeber papéis de tornassol em uma mistura de diferentes substâncias indicadoras, o que aumenta a faixa dos níveis de pH. Além disso, muitos laboratórios usam papéis de tornassol universais prontos que mudam de cor na faixa do vermelho ao verde, sugerindo adequadamente o pH testado com base em uma escala anexa. Tal determinação nos permite estimar apenas o valor do pH com uma precisão de 0,5 unidade na escala de pH. Um método mais preciso para medir o valor do pH é a titulação ácido-base, que inclui os subtipos de alcalinometria (titulação com uma solução básica padronizada) e acidimetria (titulação com uma solução ácida padronizada). Utiliza um titulante de concentração conhecida que, ao reagir com a substância testada, varia continuamente a concentração de íons hidrônio presentes na solução. Tal determinação pode ser realizada de duas maneiras: visualmente, ao determinar o ponto final, juntamente com a mudança de cor ou com o uso de métodos instrumentais, por exemplo, potenciometria ou condutometria. Como o nome sugere, o uso de um medidor de pH também nos permite definir o valor de pH da substância. O instrumento, operando baseado em potenciometria, possui uma célula em dois eletrodos idênticos. Um deles, denominado eletrodo indicador, deve ser colocado na solução testada. O outro (eletrodo comparativo) é colocado na solução padrão com um valor de pH conhecido. Uma substância comumente usada é a solução de cloreto de prata. Ambos os eletrodos são conectados com um voltímetro extremamente sensível, que converte continuamente a EMF (força eletromotriz) em um determinado resultado na escala de pH. Segundo a teoria de Nernst, a força eletromotriz (CEM) da célula, constituída por dois eletrodos idênticos imersos em soluções com valores de pH diferentes, é diretamente proporcional ao logaritmo do quociente de ambas as concentrações.
Métodos caseiros para medir o valor do pH
Acontece que existem muitos indicadores naturais de pH , e o valor aproximado do pH pode ser medido no ambiente doméstico. Por exemplo, uma infusão feita de folhas de chá preto fica mais brilhante quando misturada com um ácido, por exemplo, suco de limão. Por outro lado, fica mais escuro sob a influência de bases como uma solução de bicarbonato de sódio. O suco de repolho roxo muda de cor de violeta para vermelho quando submetido a um ácido, ou para azul quando misturado a uma base.
