Olhando para sua estrutura, os ácidos carboxílicos são compostos orgânicos importantes e são derivados de acil. Eles são um tipo de material de construção para muitos derivados, incluindo ésteres e amidas. Na natureza, podemos encontrar toda uma gama de vários ácidos carboxílicos, como o ácido acético CH 3 COOH, que é o composto básico do vinagre de mesa, o ácido butírico CH 3 CH 2 CH 2 COOH responsável pelo cheiro de manteiga rançosa, ou mais ácido cólico complexo, que é o componente básico dos sucos biliares humanos.

A fórmula geral dos ácidos carboxílicos é:
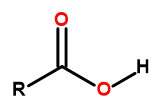
Figure1 A fórmula geral dos ácidos carboxílicos é:
Nomenclatura dos ácidos carboxílicos
De acordo com o sistema de nomenclatura IUPAC, os ácidos carboxílicos podem ser nomeados de duas maneiras, dependendo do tamanho e da complexidade da molécula. Ácidos que são derivados alifáticos são nomeados sistematicamente mudando a terminação do alcano de -ano para -óico e adicionando a palavra inicial “ácido”, por exemplo, ácido propanóico, ácido butanóico, ácido 3-etil-6-metiloctanodióico. A numeração dos átomos de carbono em tais compostos químicos sempre começa com o átomo no grupo funcional –COOH. O segundo sistema de nomenclatura, especialmente útil para ácidos nos quais o grupo carboxila está ligado ao anel, permite adicionar as palavras “ácido” antes e “carboxílico” depois dele ao nome sistemático do composto. Nesses casos, a numeração dos átomos de carbono começa com o átomo ao qual o grupo carboxila está ligado, o qual é tratado como um substituinte.
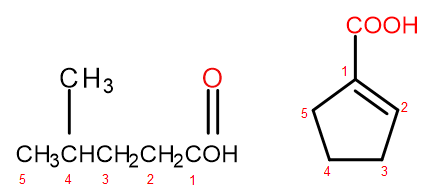
Figura 2 Numeração dos átomos de carbono, da esquerda para a direita: ácido 4-metilpentanóico, ácido 1-ciclopentenocarboxílico.
| Ácido carboxílico | grupo acil | ||
| Estrutura | Nome | Estrutura | Nome |
| HCOOH | Fórmico | HCO- | Formil- |
| CH 3 COOH | Acético | CH 3 CO- | Acetil- |
| CH 3 CH 2 CH 2 COOH | butírico | CH 3 CH 2 CH 2 CO- | Butiril- |
| HOOOCCOOH | Oxálico | -OCCO- | Oxalil- |
| HOOC(CH 2 ) 2 COOH | succínico | -OC(CH 2 ) 2 CO- | succinil- |
A estrutura e as propriedades físicas dos ácidos carboxílicos
A semelhança do grupo carboxila com cetonas e álcoois pode sugerir propriedades físicas semelhantes. Como nas cetonas, o átomo de carbono do grupo funcional tem uma hibridação sp 2 . Isso está diretamente relacionado à sua estrutura plana e ângulos de cerca de 120 o entre as ligações CCO e OCO. Por exemplo, o ácido acético CH 3 COOH tem ângulos de ligação iguais a:
- 119 o para CC=O,
- 119 o para CC-OH,
- 122º para O =C-OH.
Os comprimentos de ligação são os seguintes:
- 52Å para CC,
- 25Å para C=O,
- 31Å para C-OH.
Os ácidos carboxílicos apresentam sua semelhança com os álcoois devido à sua forte associatividade causada pela possibilidade de formação de pontes de hidrogênio. Na prática, a maioria desses compostos existe como dímeros cíclicos cuja estrutura é mantida pela formação de pontes de hidrogênio. Esse sistema específico de pontes de hidrogênio também afeta os pontos de ebulição dos ácidos carboxílicos. Causa seu aumento significativo em comparação com os álcoois correspondentes. Por exemplo, constantes físicas – o ponto de fusão e o ponto de ebulição em graus Celsius são respectivamente:
- Ácido fórmico : 8,4; 100,7,
- Ácido acético: 16,6; 117.9,
- Ácido propanoico: -20,8; 141,
- Ácido benzóico: 122,1; 249.
Dissociação de ácidos carboxílicos
As propriedades ácidas deste grupo de compostos permitem que reajam com bases, incluindo o hidróxido de sódio e o bicarbonato de potássio. Os produtos dessas reações são sais de ácidos carboxílicos. A solubilidade dos ácidos carboxílicos em água é insignificante, mas seus sais com metais alcalinos, devido à sua estrutura iônica, dissolvem-se muito bem em água. Esses compostos, que são ácidos na teoria de Bronsted-Lowry, dissociam-se em soluções aquosas diluídas. Como resultado da transformação, o ânion carboxilato RCOO – e o cátion hidrônio H 3 O + são formados.
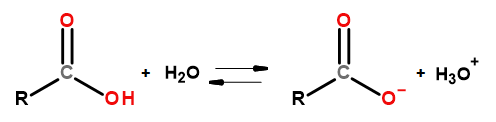
Figura 3Esquema de dissociação do ácido carboxílico.
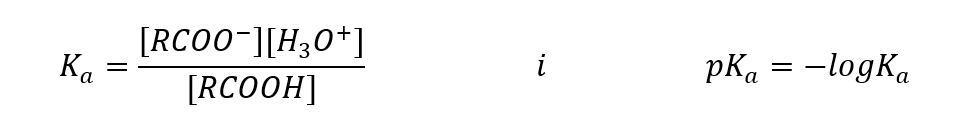 Valores determinados empiricamente para ácidos carboxílicos mostram que eles são compostos fracamente dissociados, portanto, na prática, também são ácidos fracos. Para a maioria deles, a constante K a assume um valor de cerca de 10 -5 . Para o ácido acético K a = 1,76·10 -5 , o que, após a conversão, dá ao pK um valor igual a 4,75. Isso equivale à dissociação de apenas cerca de 0,1 %das moléculas, o que, em comparação com ácidos inorgânicos fortes com um grau de dissociação de 100%, confirma que são ácidos de baixa resistência. Comparados aos álcoois, cujas constantes de equilíbrio oscilam na ordem de grandeza 10 -16 , os ácidos carboxílicos são muito mais fortes. Apesar da semelhança estrutural, esse fato se deve à estabilidade do ânion carboxilato em relação ao ânion alcóxido. Observe que a carga negativa nos alcóxidos está em um único átomo de oxigênio, que é altamente eletronegativo. Em contraste, nos ânions carboxilato, a carga é deslocalizada entre os dois oxigênios do grupo funcional. Isso o torna mais estável em comparação com o ânion produzido pelos álcoois.
Valores determinados empiricamente para ácidos carboxílicos mostram que eles são compostos fracamente dissociados, portanto, na prática, também são ácidos fracos. Para a maioria deles, a constante K a assume um valor de cerca de 10 -5 . Para o ácido acético K a = 1,76·10 -5 , o que, após a conversão, dá ao pK um valor igual a 4,75. Isso equivale à dissociação de apenas cerca de 0,1 %das moléculas, o que, em comparação com ácidos inorgânicos fortes com um grau de dissociação de 100%, confirma que são ácidos de baixa resistência. Comparados aos álcoois, cujas constantes de equilíbrio oscilam na ordem de grandeza 10 -16 , os ácidos carboxílicos são muito mais fortes. Apesar da semelhança estrutural, esse fato se deve à estabilidade do ânion carboxilato em relação ao ânion alcóxido. Observe que a carga negativa nos alcóxidos está em um único átomo de oxigênio, que é altamente eletronegativo. Em contraste, nos ânions carboxilato, a carga é deslocalizada entre os dois oxigênios do grupo funcional. Isso o torna mais estável em comparação com o ânion produzido pelos álcoois.
Obtenção de ácidos carboxílicos
- Oxidação de alquilbenzenos substituídos com KMnO 4 ou Na 2 Cr 2 O 7 com o produto na forma de ácidos benzóicos substituídos. É possível oxidar grupos alquil primários e secundários,
- Oxidação da ligação C=C em alcenos com pelo menos um átomo de hidrogênio vinílico usando KMnO 4 ,
- Oxidação de álcoois primários e aldeídos. Álcoois usando o reagente de Jones, aldeídos usando o mesmo reagente e óxido de prata básico,
- Hidrólise de nitrilos sob a influência de soluções fortes e quentes de ácidos ou bases,
- A reação dos compostos de Grignard com dióxido de carbono, com um produto intermediário na forma de carboxilato de magnésio. O composto de transição então reage com o ácido.
Reações de ácidos carboxílicos
Devido à sua estrutura, os ácidos carboxílicos, além de suas reações características, também sofrem transformações semelhantes aos álcoois e cetonas. Como os álcoois, eles podem dissociar um próton para formar um reagente nucleofílico. Assim como as cetonas, eles estão sujeitos a ataques de outros nucleófilos no átomo de carbono do grupo carbonila. Além disso, são possíveis sua redução, substituição na posição alfa, substituição nucleofílica do grupo acil e desprotonação (dissociação). A redução dos ácidos carboxílicos ocorre com LiAlH 4 , resultando no produto como um álcool primário. Às vezes é necessário aplicar aquecimento em uma solução de tetrahidrofurano para aumentar a eficiência. Outro método é a redução usando borano em solução de tetrahidrofurano, obtendo também 1 o álcoois.
