Os aminoácidos são um grupo de compostos orgânicos cuja estrutura consiste em átomos de carbono, nitrogênio, hidrogênio e oxigênio, bem como um grupo de cadeia lateral variável. São compostos bifuncionais cujas moléculas incluem grupos carboxila COOH e grupos NH 2 amina.

A fórmula geral dos aminoácidos é a seguinte: NH 2 – R – COOH Seu nome é uma forma abreviada do termo “ácido α-amino carboxílico”. Quando falamos sobre diferentes tipos de aminoácidos, frequentemente substituímos seus nomes sistemáticos por nomes habituais. Para dar um exemplo, o ácido aminoacético é denominado glicina, o ácido 2-aminopropanóico é denominado alanina e o ácido 2-amino-3-metilbutanóico é denominado valina.
Classificação de aminoácidos
A principal divisão dos aminoácidos é em tipos proteicos e não proteicos. O primeiro grupo inclui cerca de 20 compostos, cada um dos quais é um componente das proteínas e é crucial para o corpo humano. Essas proteínas, que também existem como moléculas estruturais em plantas e animais, desempenham um papel fundamental ao participarem de diversos mecanismos responsáveis pela manutenção da homeostase no corpo humano. Outra classificação leva em consideração a possibilidade de produção de um determinado aminoácido ou seu fornecimento necessário ao corpo humano junto com os alimentos.
Aminoácidos exógenos e endógenos
Os aminoácidos exógenos são compostos orgânicos necessários para manter a homeostase em nossos corpos, mas não são capazes de autoprodução. É por isso que devem ser fornecidos sob a forma de uma dieta adequada, juntamente com refeições devidamente equilibradas e sob a forma de suplementos adequados. Este grupo de aminoácidos inclui:
- Lisina – um aminoácido antivírus que melhora a imunidade;
- Metionina, que controla a produção do hormônio do crescimento;
- Treonina, responsável pela manutenção adequada da umidade da pele e pelo bom funcionamento do sistema nervoso;
- Leucina, cuja principal função é controlar o nível de cortisol secretado e os níveis de açúcar, bem como apoiar a cicatrização de feridas;
- Isoleucina – aminoácido que participa nos processos do metabolismo muscular, com especial incidência nos tecidos musculares;
- Valina, que auxilia na recuperação muscular e na remoção do excesso de tecido adiposo;
- Triptofano, precursor da serotonina, que tem como função aumentar a qualidade do sono, melhorar o estado físico e mental e controlar o apetite;
- Fenilalanina, sendo um precursor de muitos hormônios importantes para o corpo humano, incluindo tirosina, dopamina, epinefrina e noradrenalina.
A outra categoria inclui aminoácidos endógenos , que são sintetizados regularmente no corpo humano, de modo que a demanda por eles é constantemente atendida de forma autônoma. Este grupo contém mais aminoácidos, que incluem:
- Alanina – um aminoácido responsável por transportar glicose para os glóbulos vermelhos e para o cérebro;
- Ácido aspártico, que melhora as funções cognitivas e a capacidade de concentração;
- Asparagina, que apoia muitos processos como aprendizagem, memorização ou melhoria da concentração;
- O ácido glutâmico, que auxilia nos processos de digestão, reduz a sensação de fadiga e apoia a memória.
Aminoácidos condicionais
Estes são compostos que podem ser produzidos no corpo, mas apenas em caso de acesso a quantidades adequadas dos seus precursores. Os aminoácidos condicionais incluem:
- Arginina, que retarda o envelhecimento, reduz o tempo de cicatrização de feridas e melhora a aptidão física;
- Cisteína, que é um material de construção na formação de glutationa e importante elemento de produção de colágeno;
- Glutamina, que apoia o funcionamento do intestino e a remoção de produtos metabólicos desnecessários do corpo humano;
- Tirosina, que, assim como a cisteína, participa da produção do colágeno, mas também é necessária para a síntese da melanina e ajuda a manter a homeostase da glândula tireoide;
- Glicina, que é um aminoácido capaz de curar artrite e diabetes;
- Ornitina, que é capaz de reduzir o nível de cortisol, melhorar a qualidade do sono e aumentar a eficiência das funções intestinais e das enzimas digestivas;
- Prolina, que afeta favoravelmente o estado da pele e melhora a sua flexibilidade;
- Serina, orientada para processos que apoiam o sistema imunológico e o funcionamento dos neurônios.
Aminoácidos proteicos
Como o nome sugere, também existem aminoácidos que são componentes das proteínas. Mais especificamente, as proteínas são vários tipos de aminoácidos combinados entre si. São vinte e durante a síntese são codificados pelos chamados códons (sequências de três nucleotídeos contidas no mRNa, que constituem a unidade codificadora). Cada um deles tem duas características comuns: são alfa e L-aminoácidos. Isso significa que seu grupo amina está conectado ao carbono alfa, que está diretamente adjacente ao grupo carbonila. A letra “L” representa um estereoisômero na projeção de Fischer, portanto o grupo amina está localizado no lado esquerdo da fórmula. 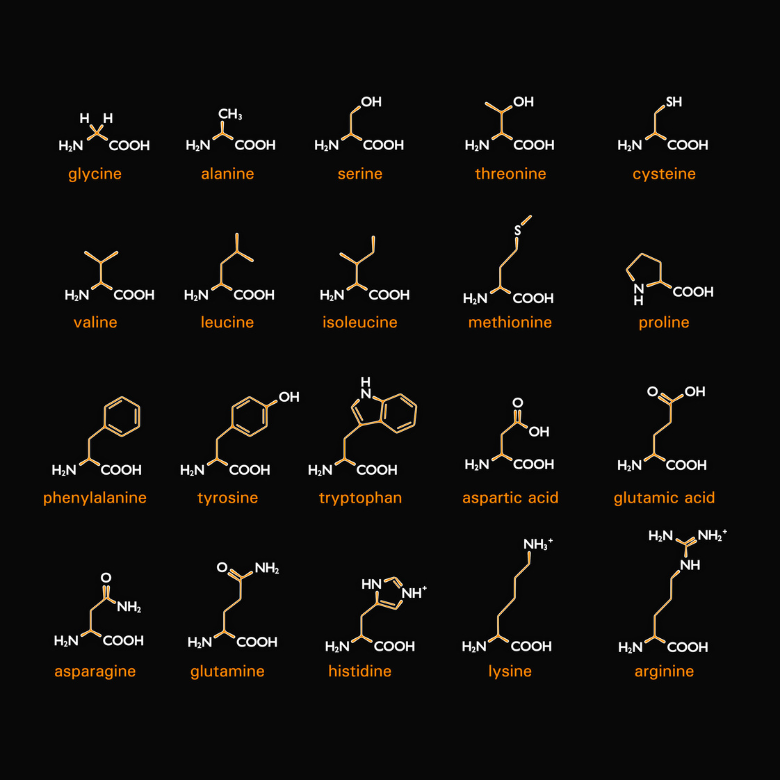
As propriedades físico-químicas dos aminoácidos
A forma física dos aminoácidos é geralmente um sólido cristalino com sabor adocicado. Sua solubilidade em água é boa, mas não se dissolvem em solventes orgânicos. Seus pontos de fusão são relativamente altos. A natureza química dos aminoácidos é anfotérica e a reação de suas soluções aquosas é neutra. A dissociação produz íons duais, que são o resultado da neutralização do grupo amina básico com um radical carboxila. Isso resulta na produção de um sal de amônio interno que apresenta ambas as cargas: positiva e negativa. Suas quantidades são iguais. Um aminoácido pode existir como cátion ou ânion, dependendo do ambiente em que se dissocia. Para reações ácidas, o grupo carboxila não se dissocia e o aminoácido tem carga positiva. Em um ambiente alcalino, as reações mudam para a produção de um íon negativo.
O ponto isoelétrico (pI)
É um ponto onde um aminoácido assume a forma de um íon duplo. Para cada molécula, podemos ajustar uma concentração adequada de íons [H 3 O +], ou seja, um pH onde os íons não se movem no campo elétrico. A natureza anfotérica dos aminoácidos e a sua existência na forma de iões duais implica uma estrutura iónica dos sais quando afectados por ácidos e álcalis. A determinação experimental do ponto isoelétrico é realizada adicionando um aminoácido, por exemplo caseína, em tubos de ensaio apropriados contendo soluções (CH 3 COOH e CH 3 COONa) com concentrações de pH conhecidas. O ponto isoelétrico é alcançado onde o depósito é mais abundante. Dada a característica do ponto isoelétrico, podemos utilizá-lo para separar uma mistura de proteínas com o uso da eletroforese. Este método baseia-se nas propriedades ácido-básicas dos aminoácidos, e a mistura é colocada sobre papel umedecido. Com o uso de um pH conhecido, podemos determinar a forma em que determinados aminoácidos existirão. Então, se fornecermos tensão ao papel, os aminoácidos com carga positiva se moverão em direção ao cátodo (-), e aqueles com carga negativa, em direção ao ânodo (+). Os compostos com carga neutra, equilibrados pelas cargas positivas e negativas da molécula, permanecerão no mesmo lugar.
Reações características do grupo carboxila
- Esterificação, que consiste na síntese de ésteres produzidos pela reação entre um aminoácido e um álcool. O produto de tal reação não apresenta natureza anfotérica, mas apresenta as propriedades da amina utilizada.
- Descarboxilação, que é o aquecimento de um aminoácido na presença de uma solução de hidróxido de bário (II) (Ba(OH) 2 ). A transformação produz aminas.
- A produção de complexos está relacionada à capacidade dos aminoácidos de se ligarem aos cátions de um metal, principalmente o cobre, o que provoca a formação de compostos coloridos (sais complexos).

Reações características do grupo amina
- Desaminação, que diz respeito aos aminoácidos que contêm o grupo amina primária. A reação ocorre sob a influência do ácido nítrico (III) (HNO 2 ), e o aminoácido utilizado como reagente oxida e produz um hidrácido. O grupo amina é liberado na forma de nitrogênio. Existem vários tipos de desaminação, incluindo desaminação hidrolítica, desaminação hidrolítica com descarboxilação, desaminação por redução e desaminação por dessaturação.
- Oxidação, que faz com que os aminoácidos se convertam em cetoácidos.
- Reações bioquímicas – todos os aminoácidos que podem ser classificados como bases de Schiff são capazes de transformações bioquímicas como transmitância e descarboxilação.
Reações usadas para detectar aminoácidos
- A reação da ninidrina é uma reação colorida onde os reagentes são um aminoácido e um reagente na forma de uma solução de ninidrina. A reação produz uma cor azul violeta característica.
- A reação da xantoproteína é um exemplo de caminho para detectar aminoácidos aromáticos, como fenilalanina, tirosina ou triptofano. Um composto submetido a uma solução concentrada de ácido nítrico (V) (HNO 3 ) muda sua cor para amarelo. É o resultado da produção de derivados de aminoácidos nítricos durante a reação.
Fontes de aminoácidos
Para garantir um bom estado físico e mental do corpo humano, devemos fornecer-lhe quantidades adequadas de cada material de construção, incluindo aminoácidos. Uma fonte extremamente importante de todos os aminoácidos necessários ao bom funcionamento são as proteínas completas. Incluem carne, em especial aves, peixes, ovos e laticínios. O leite contém grandes quantidades de leucina, isoleucina, treonina e triptofano. A lisina e a metionina podem ser encontradas na soja. A valina pode ser fornecida juntamente com arroz, amendoim, gergelim e amêndoas, enquanto a fenilalanina, incluindo ovos, queijos e produtos à base de cereais em nossa dieta. A presença de aminoácidos em produtos alimentares é comum, mas para que a nossa alimentação seja devidamente equilibrada, os produtos que utilizamos devem ser diversificados. Isso ocorre porque eles contêm apenas alguns aminoácidos do grupo necessário para manter as funções vitais adequadas.
