Por definição, atividade química é a capacidade de um elemento doar elétrons em reações químicas. Na prática, sua atividade aumenta com a diminuição da eletronegatividade – uma medida da capacidade de um elemento de atrair elétrons. Se um metal não atrai fortemente elétrons, ele é mais reativo. Um elemento de referência, o hidrogênio, é usado para classificar a atividade química dos metais. Uma medida da atividade de um metal é sua capacidade de deslocar o hidrogênio de ácidos ou o hidrogênio de uma molécula de água.

Série de atividade química de metais
Este termo é usado para descrever o resumo dos elementos químicos de natureza metálica , em uma ordem específica do menos para o mais quimicamente ativo. Isso é usado para comparar a atividade de diferentes metais. Além dos metais, a série de atividades químicas também inclui um não metal, o hidrogênio , que é o elemento de referência. Quanto mais alto na série de atividade um metal está, mais reativo ele é . Está também relacionado com o facto de ser mais facilmente oxidado e, portanto, um redutor mais forte e um elemento quimicamente mais activo. Em contraste, quanto mais baixo na série de atividade um metal for colocado, menos reativo ele será. Isto significa que sofre mais facilmente uma reação de redução e é, portanto, um oxidante mais forte, um elemento menos ativo. Utilizando os valores apresentados na Tabela 1, podemos observar que quanto menor o valor do potencial padrão de um elemento, mais forte é o redutor e mais reativo quimicamente é o metal. Uma medida da capacidade de doar elétrons em uma série de atividades metálicas é o seu valor potencial padrão . Para o hidrogênio, ou melhor, para o eletrodo de hidrogênio, o potencial padrão é assumido como zero. O potencial padrão é a força eletromotriz de uma célula composta por uma meia célula padrão de hidrogênio e outra meia célula na qual as concentrações de substratos e produtos são de 1 mol/dm 3 .
| Eletrodo | Potencial padrão [V] |
| Li/Li + | -3.04 |
| Ca/Ca2 + | -2,86 |
| Mg/Mg 3+ | -2,36 |
| Al/Al3 + | -1,69 |
| Mn/Mn 2+ | -1,18 |
| Zn/Zn 2+ | -0,76 |
| Cr/Cr 3+ | -0,74 |
| Fe/Fe 2+ | -0,44 |
| Cd/Cd 2+ | -0,40 |
| Co/Co 2+ | -0,28 |
| Ni/Ni 2+ | -0,26 |
| Sn/Sn 2+ | -0,14 |
| Pb/Pb 2+ | -0,14 |
| Fe/Fe 3+ | 0,04 |
| H 2 /2H + | 0,00 |
| Bi/Bi 3+ | +0,32 |
| Cu/Cu 2+ | +0,34 |
| Ag/Ag + | +0,80 |
| Hg/Hg 2+ | +0,85 |
| Au/Au 3+ | +1,52 |
Tabela 1 . Série eletroquímica de metais Os metais visíveis no topo da série são os mais ativos. Aqueles acima do hidrogênio tendem a oxidar facilmente e são, portanto, agentes redutores mais fortes que o hidrogênio. Os elementos abaixo do hidrogênio na série são mais facilmente reduzidos e são oxidantes mais fortes. Se um metal tiver um potencial mais negativo que outro, isso significa que o deslocará do seu sal. Por exemplo, o ferro deslocará o cobre nos sais de cobre, mas o cobre não deslocará o ferro dos seus sais. Em vez disso, pode substituir a prata dos sais de prata. O lítio e o berílio de soluções de sais de outros metais não os deslocam, mas reagem diretamente com a água. Eles deslocam o hidrogênio e produzem seus compostos – hidróxidos . Esses metais são chamados de metais ativos. Atividade metálica e a tabela periódica dos elementos Como muitas outras propriedades, a atividade química de um elemento pode ser deduzida de sua posição na tabela periódica . Os metais mais ativos são os dos grupos I e II, pois deslocam facilmente o hidrogênio da água para formar hidróxidos. No grupo, a atividade química dos metais aumenta com o aumento do número atômico . O período diminui à medida que o número atômico aumenta. 
Metais preciosos e básicos
O hidrogênio não apenas fornece um ponto de referência de atividade, mas também separa metais preciosos e básicos na série . Os metais básicos são aqueles acima do hidrogênio. Cada um reage com ácidos, deslocando deles o hidrogênio. Do potássio ao cálcio reagem com a água já à temperatura ambiente, e do magnésio ao ferro reagem com ela a temperaturas elevadas. Todos os metais que estão abaixo do hidrogênio na série de atividades não deslocam o hidrogênio dos ácidos . No entanto, eles podem reagir com ácidos oxidantes para formar os sais e óxidos correspondentes, que são formados pela redução do resíduo ácido. Os elementos da parte inferior da série, da prata ao ouro, são tão resistentes às reações químicas que só reagem com a água régia . Tal solução é uma mistura de uma solução concentrada de ácido clorídrico e uma solução concentrada de ácido nítrico (V) , misturada numa proporção de volume de 3:1. Conhecendo estes factos, podemos deduzir que podem ser realizadas diversas reações para distinguir a atividade do elemento: com água à temperatura ambiente, com água quente, com ácido não oxidante, com ácido oxidante e com água régia.
Experimento para detectar metais deslocando hidrogênio de ácidos
A maneira mais fácil de confirmar a atividade do metal é realizar um experimento. Para isso, devem ser preparados dez tubos de ensaio nos quais serão colocados sucessivamente: em 1-5: fita de magnésio, fio de zinco, fio de ferro, fio de níquel e fio de cobre. A mesma ordem deve ser repetida nos tubos 6 a 10. Adicione alguns mililitros de ácido clorídrico aos tubos 1-5 e alguns mililitros de ácido sulfúrico diluído (VI) aos tubos 6-10. Aplique uma tala ardente em cada tubo. Em tubos de ensaio que contêm fitas de magnésio e fios de ferro, zinco e níquel, inundados com ácidos, são emitidas bolhas de gás. A liberação mais intensa pode ser observada em tubos contendo magnésio. As reações que ocorrem são as seguintes: 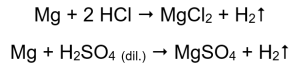 A quantidade de gás emitida diminui nas séries: zinco, ferro, níquel. As seguintes reações ocorrem de acordo:
A quantidade de gás emitida diminui nas séries: zinco, ferro, níquel. As seguintes reações ocorrem de acordo:  Nos tubos que continham fios de cobre, nenhum gás é visível, nenhuma alteração. Isso significa que tais reações não ocorrem:
Nos tubos que continham fios de cobre, nenhum gás é visível, nenhuma alteração. Isso significa que tais reações não ocorrem: 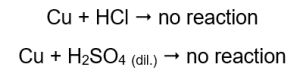 Quando uma tala em chamas é aplicada, um som distinto é ouvido nos tubos de onde o gás é emitido.
Quando uma tala em chamas é aplicada, um som distinto é ouvido nos tubos de onde o gás é emitido.
Resumo das observações e conclusões:
Magnésio, zinco, ferro e níquel reagem tanto com ácido clorídrico quanto com ácido sulfúrico (VI). Cada um desloca o hidrogênio do ácido, o que significa que eles estão mais acima na série de atividades metálicas do que o ácido. As reações produzem produtos na forma de sais e um gás, o hidrogênio, que é liberado. O som característico que acompanhou a aplicação de uma tala brilhante em um tubo de ensaio com gás escapando é causado pela reação do hidrogênio com o oxigênio. De todos os metais testados, o magnésio é o mais reativo, seguido pelo zinco, ferro, níquel e cobre. Podemos saber porque a intensidade das bolhas de gás indica a atividade do metal. Nenhuma alteração foi observada em tubos que continham cobre. Isso mostra que o cobre é incapaz de deslocar o hidrogênio do ácido clorídrico ou do ácido sulfúrico (VI) diluído.
