Uma mistura homogênea de pelo menos duas substâncias é considerada uma solução. Embora pensemos em uma solução principalmente como um líquido, misturas gasosas e sólidas também são soluções. No entanto, um grupo muito grande de reações químicas, tanto em escala laboratorial quanto industrial, ocorre em meio aquoso. Existem três tipos de soluções líquidas – o solvente é sempre líquido, mas o soluto pode ser um gás, líquido ou sólido. Entre os exemplos estão soluções aquosas de cloreto de hidrogênio, etanol e sal de cozinha.

Descrevendo a composição da solução
A característica mais importante de qualquer solução é a definição de sua composição. A capacidade de determinar a composição de uma solução e recalculá-la dependendo das unidades de interesse é uma habilidade básica de todo químico. A quantidade de determinado ingrediente em uma mistura pode ser definida de várias formas, por exemplo, por massa, volume ou molaridade. Por isso, também existem vários tipos de concentração, definindo a dependência da quantidade do componente com a quantidade da solução ou mistura. Na maioria das vezes, ao descrever a composição das soluções, usamos os termos: fração de massa, fração de volume, fração molar e concentração molar. As frações indicam que parte de uma determinada mistura o ingrediente de interesse representa. Eles podem ser expressos em unidades de massa, volume ou moles do composto.
concentração molar
Esta é a concentração mais frequentemente escolhida, devido à conveniência de uso ao determinar o número de moles da substância contida no volume da solução. A base teórica é a afirmação de que soluções de duas substâncias diferentes da mesma concentração e volume, na mesma temperatura, contêm o mesmo número de moles e, portanto, o mesmo número de moléculas do soluto. Com base nesta relação, para soluções com concentrações molares iguais é possível misturar volumes apropriados de soluções para atingir a proporção correta do número de moles determinado pelos coeficientes estequiométricos. Isso significa que, se pensarmos em reações do tipo A + B → C, onde um mol da substância A reage com um mol da substância B, volumes iguais das duas soluções com a mesma concentração molar devem ser misturados para que a reação ocorra completamente. No caso de uma reação do tipo A + 2B → C, ou seja, um mol da substância A reage com dois mols da substância B, deve-se misturar um volume da solução A com dois volumes da solução B. A concentração molar, denotada por C m , define o número de moles de uma substância contida em uma unidade de volume, geralmente em 1 dm 3 , de uma solução. A fórmula que permite o cálculo da concentração molar é o quociente entre o número de moles da substância (n s ) e o volume total da solução (V sol ) em dm 3 : 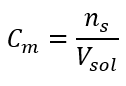 Usando a unidade básica de volume de acordo com o sistema SI, ou seja, metro cúbico, quilomoles devem ser usados como a unidade da quantidade da substância. No entanto, este não é um grande problema computacional, porque
Usando a unidade básica de volume de acordo com o sistema SI, ou seja, metro cúbico, quilomoles devem ser usados como a unidade da quantidade da substância. No entanto, este não é um grande problema computacional, porque 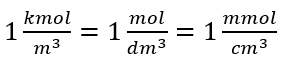 . A unidade de concentração molar C m é definida como mol por decímetro cúbico, muitas vezes notado como M. 1 mol/dm 3 = 1M
. A unidade de concentração molar C m é definida como mol por decímetro cúbico, muitas vezes notado como M. 1 mol/dm 3 = 1M 
O uso da concentração molar
a) Cálculo da concentração molar com base no teor do componente na solução Exemplo 1. A solução contém 30 g de hidróxido de potássio em 3,0 dm 3 da solução. Calcule sua concentração molar. Etapa 1. Cálculo da massa molar de KOH 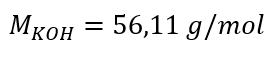 Etapa 2. Cálculo do número de moles de KOH na solução
Etapa 2. Cálculo do número de moles de KOH na solução 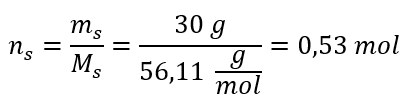 Etapa 3. Cálculo da concentração molar usando a fórmula
Etapa 3. Cálculo da concentração molar usando a fórmula 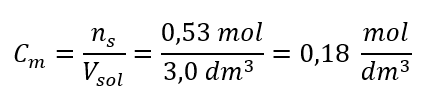 Resposta: A concentração molar de uma solução de hidróxido de potássio contendo 30 g da substância em 3,0 dm 3 da solução é C m =
Resposta: A concentração molar de uma solução de hidróxido de potássio contendo 30 g da substância em 3,0 dm 3 da solução é C m = 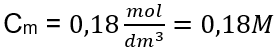 b) Preparação de uma solução com uma dada concentração Exemplo 2. Calcule a massa de glucose (C 6 H 12 O 6 ) necessária para a preparação de 300 cm 3 de uma solução com uma concentração de 0,32 mol/dm 3 . Etapa 1. Cálculo da massa molar da glicose
b) Preparação de uma solução com uma dada concentração Exemplo 2. Calcule a massa de glucose (C 6 H 12 O 6 ) necessária para a preparação de 300 cm 3 de uma solução com uma concentração de 0,32 mol/dm 3 . Etapa 1. Cálculo da massa molar da glicose 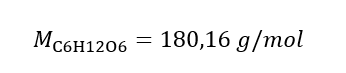 Etapa 2. Cálculo da massa de glicose necessária, usando a fórmula molar convertida, sabendo que
Etapa 2. Cálculo da massa de glicose necessária, usando a fórmula molar convertida, sabendo que 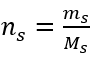 :
: 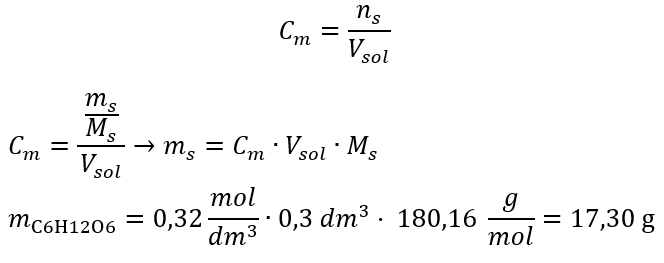 Após esses cálculos, sabemos que para preparar tal solução, 17,30 g de glicose devem ser pesados e transferidos quantitativamente para um balão volumétrico de 300 cm 3 . Resposta: Para preparar 300 cm 3 de uma solução de glicose com concentração molar de 0,32 mol/dm 3 , deve-se pesar 17,30 g da substância. c) Diluição e concentração de soluções concentradas Usando a concentração molar, também podemos preparar uma solução de uma dada concentração (C m2 ) diluindo a solução concentrada (C m1 ), onde:
Após esses cálculos, sabemos que para preparar tal solução, 17,30 g de glicose devem ser pesados e transferidos quantitativamente para um balão volumétrico de 300 cm 3 . Resposta: Para preparar 300 cm 3 de uma solução de glicose com concentração molar de 0,32 mol/dm 3 , deve-se pesar 17,30 g da substância. c) Diluição e concentração de soluções concentradas Usando a concentração molar, também podemos preparar uma solução de uma dada concentração (C m2 ) diluindo a solução concentrada (C m1 ), onde: 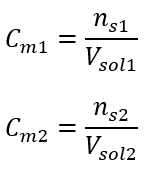 Durante a diluição, apenas o volume da solução muda, o número de moles do soluto permanece inalterado. Então pode-se supor que:
Durante a diluição, apenas o volume da solução muda, o número de moles do soluto permanece inalterado. Então pode-se supor que: ![]() Transformando a fórmula para concentração molar, obtemos as seguintes relações:
Transformando a fórmula para concentração molar, obtemos as seguintes relações: 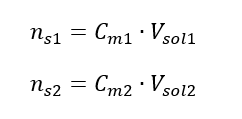 Sabendo disso, obtemos a equação:
Sabendo disso, obtemos a equação: 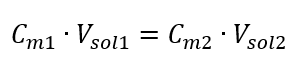 A fórmula para a diluição das soluções, considerando a concentração molar, incluindo a recém-obtida (C mx ) pode ser anotada como:
A fórmula para a diluição das soluções, considerando a concentração molar, incluindo a recém-obtida (C mx ) pode ser anotada como: 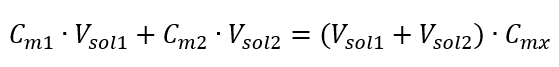 Exemplo 3. Que volume de ácido 0,150 mol/dm 3 pode ser obtido diluindo 250 cm 3 de uma solução 0,750 mol/dm 3 desse ácido com água? Etapa 1. Transformação da fórmula assumindo que a concentração de água é C m2 = 0 mol/dm 3 .
Exemplo 3. Que volume de ácido 0,150 mol/dm 3 pode ser obtido diluindo 250 cm 3 de uma solução 0,750 mol/dm 3 desse ácido com água? Etapa 1. Transformação da fórmula assumindo que a concentração de água é C m2 = 0 mol/dm 3 . 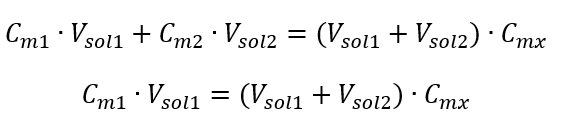 Etapa 2. Cálculo do volume total (V x )
Etapa 2. Cálculo do volume total (V x ) 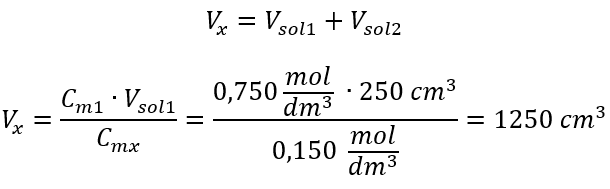 Alternativamente, as relações de permanência do número de moles durante a diluição podem ser usadas:
Alternativamente, as relações de permanência do número de moles durante a diluição podem ser usadas: 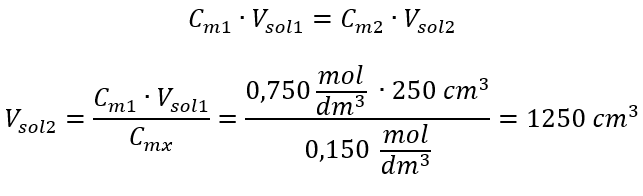 Resposta: Para diluir o ácido na concentração necessária, deve-se usar 1,25 dm 3 de água. Exemplo 4. Calcule quanta água deve ser evaporada de 300 cm 3 de uma solução com concentração de 0,125 mol/dm 3 para obter uma solução com concentração de 1,50 mol/dm 3 . Passo 1. Transformação da fórmula para a mudança na concentração molar com a suposição de que a concentração molar de água é C m2 = 0 mol/dm 3 .
Resposta: Para diluir o ácido na concentração necessária, deve-se usar 1,25 dm 3 de água. Exemplo 4. Calcule quanta água deve ser evaporada de 300 cm 3 de uma solução com concentração de 0,125 mol/dm 3 para obter uma solução com concentração de 1,50 mol/dm 3 . Passo 1. Transformação da fórmula para a mudança na concentração molar com a suposição de que a concentração molar de água é C m2 = 0 mol/dm 3 . 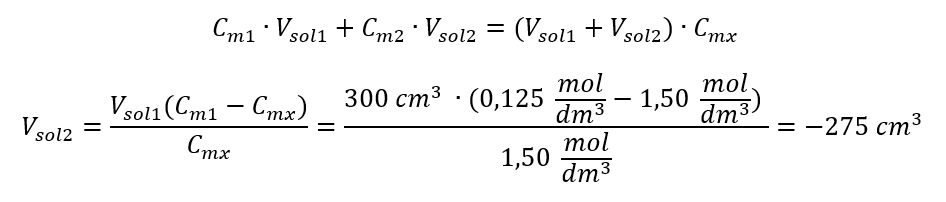 Resposta: Para concentrar a solução, 275 deve ser evaporado. A conversão de concentração molar versus concentração percentual No trabalho diário de laboratório, é necessário converter diferentes concentrações de soluções. Na maioria das vezes, a concentração molar e a concentração percentual são usadas. É possível alternar entre eles usando a densidade da solução. Este parâmetro deve ser introduzido nas fórmulas das concentrações de interesse:
Resposta: Para concentrar a solução, 275 deve ser evaporado. A conversão de concentração molar versus concentração percentual No trabalho diário de laboratório, é necessário converter diferentes concentrações de soluções. Na maioria das vezes, a concentração molar e a concentração percentual são usadas. É possível alternar entre eles usando a densidade da solução. Este parâmetro deve ser introduzido nas fórmulas das concentrações de interesse: 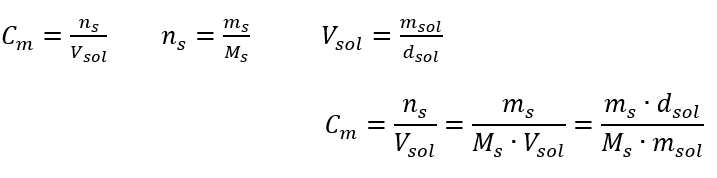 Na transformação, podemos ver a relação entre a massa da substância e a massa da solução, que é a base da concentração percentual, expressa pela fórmula:
Na transformação, podemos ver a relação entre a massa da substância e a massa da solução, que é a base da concentração percentual, expressa pela fórmula: 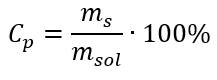 Substituindo a fórmula da concentração percentual na fórmula previamente transformada da concentração molar, obtemos uma relação que nos permite alternar livremente entre os dois valores:
Substituindo a fórmula da concentração percentual na fórmula previamente transformada da concentração molar, obtemos uma relação que nos permite alternar livremente entre os dois valores: 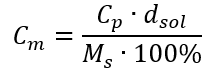 A única limitação da fórmula é o uso de unidades apropriadas, por isso vale a pena considerá-las em todos os cálculos. Exemplo 5. Calcule a concentração molar de ácido sulfúrico (VI) sabendo que sua concentração percentual é C p = 98,0%e sua densidade é d = 1,84 kg/dm 3 . Isso pode ser calculado usando dois métodos: Método 1. Em poucas etapas, sem usar uma fórmula Etapa 1. Cálculo da massa de 1,00 dm 3 do ácido
A única limitação da fórmula é o uso de unidades apropriadas, por isso vale a pena considerá-las em todos os cálculos. Exemplo 5. Calcule a concentração molar de ácido sulfúrico (VI) sabendo que sua concentração percentual é C p = 98,0%e sua densidade é d = 1,84 kg/dm 3 . Isso pode ser calculado usando dois métodos: Método 1. Em poucas etapas, sem usar uma fórmula Etapa 1. Cálculo da massa de 1,00 dm 3 do ácido 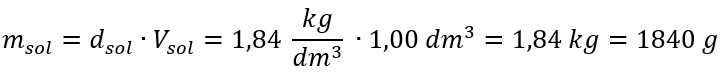 Etapa 2. Cálculo da massa do ácido levando em consideração a concentração percentual
Etapa 2. Cálculo da massa do ácido levando em consideração a concentração percentual 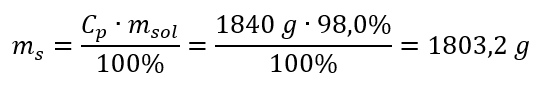 Etapa 3. Cálculo do número de moles
Etapa 3. Cálculo do número de moles 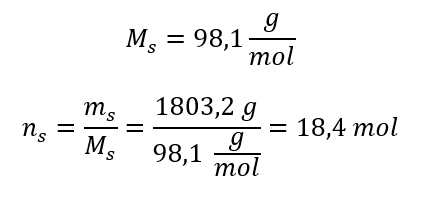 Passo 4. Cálculo da concentração molar sabendo que é o número de moles da substância em 1 dm 3 da solução
Passo 4. Cálculo da concentração molar sabendo que é o número de moles da substância em 1 dm 3 da solução 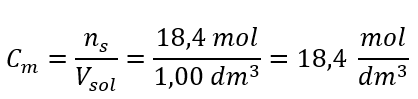 Método 2. Usando a relação entre concentração percentual e concentração molar
Método 2. Usando a relação entre concentração percentual e concentração molar 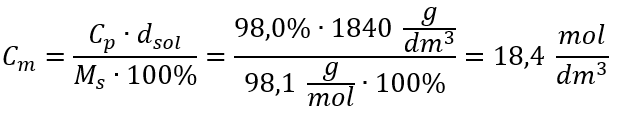 Resposta: A concentração molar desse ácido é 18,4 mol/dm 3 .
Resposta: A concentração molar desse ácido é 18,4 mol/dm 3 .
