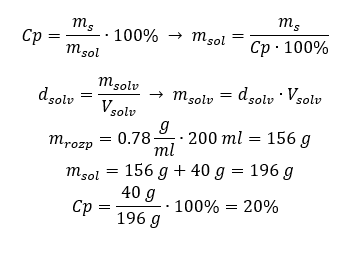Em química, muitas vezes usamos termos como “solução concentrada”, “solução diluída” ou “solução saturada”, mas eles nos dão apenas um esboço básico de se a solução contém uma quantidade grande ou pequena de uma determinada substância. No entanto, existem alguns métodos que nos ajudam a determinar com precisão a composição quantitativa de uma determinada solução. Um deles é discutido no próximo artigo.

Definição de concentração percentual
O termo “concentração” refere-se a uma medida da quantidade de uma determinada substância contida em uma solução particular . A concentração pode ser expressa em unidades com base nas medidas que usamos, por exemplo, em moles, gramas ou em porcentagem. A concentração percentual indica quantas partes em massa do soluto estão incluídas em 100 partes em massa da solução. Ou seja, é a quantidade de gramas do soluto em 100 g de solução. Por exemplo, se comprarmos leite rotulado com 3,2%, significa que 100 g de leite contém 3,2 g de gordura. A concentração percentual é abreviada como Cp.
Fórmula geral de concentração percentual
Para derivar a fórmula da concentração percentual, deve-se lembrar que a massa de uma solução (m sol ) contém não apenas a massa do solvente (m solv ) , mas também a massa do soluto (m s ) : m sol = m solv + m s Por exemplo, se tomarmos uma solução de 4%com uma massa de 100 g, sabemos que Cp = 4%, então a massa da substância é de 4 g. A definição de concentração percentual indica que, se a massa da solução for 100 g, a massa do solvente será 96 g. A concentração percentual pode ser calculada com a seguinte fórmula: Cp = (m s /m sol ) · 100%Como podemos ver na fórmula, se conhecermos a massa da solução e a massa da substância, podemos facilmente calcular a concentração percentual. Por exemplo, se sabemos que a solução pesa 450 g e o soluto pesa 15 g, inserindo esses números na fórmula, obtemos o seguinte: Cp = (15/450) · 100%= 3,3%
Calculando a massa de ingredientes individuais em uma solução
Cada fórmula, incluindo a de concentração percentual, pode ser reorganizada. Se conhecermos a massa e a concentração percentual da solução, podemos calcular a massa do soluto. Da mesma forma, se conhecermos a concentração percentual e a massa da substância, podemos calcular a massa da solução. Além de reorganizar a fórmula, também podemos usar proporções adequadas. Exemplo 1. Quantos gramas de açúcar precisamos para preparar 300 g de uma solução a 10%? Sabemos pelas instruções que a massa da solução é de 300 g e que sua concentração percentual é de 10%. A massa do soluto pode ser determinada com dois métodos. Método 1. Reorganizando a fórmula 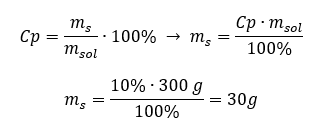 Método 2. Usando as proporções , sabendo que a solução a 10%contém 10 g de açúcar em 100 g de solução:
Método 2. Usando as proporções , sabendo que a solução a 10%contém 10 g de açúcar em 100 g de solução: 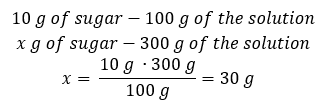 Ambos os métodos nos levarão à conclusão de que a preparação de 300 g de uma solução a 10%exigirá 30 g de açúcar.
Ambos os métodos nos levarão à conclusão de que a preparação de 300 g de uma solução a 10%exigirá 30 g de açúcar.  Exemplo 2. Em quantos gramas de água devemos dissolver 10 g de uma substância para obter uma solução a 50%? Sabemos pelas instruções que a massa da substância é de 10 g e que a concentração percentual da solução é de 50%. Isso implica que 100 g da solução contém 50 g da substância. A massa da solução pode ser determinada com dois métodos. Observe que a massa da solução não é igual à massa do solvente. Para calcular a massa do solvente, temos que subtrair a massa da substância da massa da solução. Método 1. Reorganizando a fórmula
Exemplo 2. Em quantos gramas de água devemos dissolver 10 g de uma substância para obter uma solução a 50%? Sabemos pelas instruções que a massa da substância é de 10 g e que a concentração percentual da solução é de 50%. Isso implica que 100 g da solução contém 50 g da substância. A massa da solução pode ser determinada com dois métodos. Observe que a massa da solução não é igual à massa do solvente. Para calcular a massa do solvente, temos que subtrair a massa da substância da massa da solução. Método 1. Reorganizando a fórmula 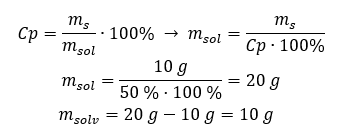 Método 2. Usando as proporções , sabendo que 100 g da solução contém 50 g da substância.
Método 2. Usando as proporções , sabendo que 100 g da solução contém 50 g da substância. 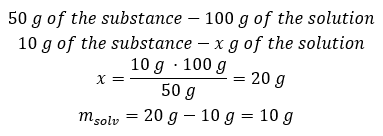 Independentemente do método que usarmos, a resposta será que, para obter uma solução de 50%, devemos dissolver 10 g da substância em 10 g de água.
Independentemente do método que usarmos, a resposta será que, para obter uma solução de 50%, devemos dissolver 10 g da substância em 10 g de água.
Preparando soluções
Um elemento-chave do trabalho em um laboratório é o conhecimento de como preparar soluções com concentrações específicas. Para isso, temos que saber a massa de seus ingredientes. Uma massa previamente calculada de uma substância deve ser dissolvida em um volume medido com precisão de um solvente. O volume necessário pode ser calculado se conhecermos a massa e a densidade do líquido. A densidade da solução é um valor físico específico para cada líquido, que define a massa da solução por unidade de volume. Esse valor está intimamente relacionado com a temperatura. Se sabemos que a densidade da solução é 2,03 g/ml, também sabemos que 1 ml da solução pesa 2,03 g. Normalmente usamos as seguintes unidades de densidade: g/ml = g/cm 3 , g/l = g/dm 3 , mas também existem outras, como kg/m 3 . A densidade da solução é calculada com a seguinte fórmula: d sol =m sol /v sol , onde m sol é a massa da solução e V sol é sua densidade. Se conhecermos o volume e a densidade da solução, podemos calcular sua massa. Exemplo 3. Qual é a massa de 20 ml de uma solução com densidade de 1,201 g/ml? Método 1. Reorganizando a fórmula 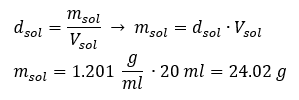 Método 2. Usando as proporções , sabendo que 1,201 g da solução tem volume de 1 ml
Método 2. Usando as proporções , sabendo que 1,201 g da solução tem volume de 1 ml 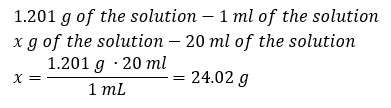 Ambos os métodos demonstraram que a solução com densidade de 1,201 g/ml e volume de 20 ml tem massa de 24,02 g. Se conhecermos a densidade, podemos realizar ainda mais cálculos no contexto da concentração percentual. Exemplo 4. Quantos gramas de sal estão contidos em 10 ml de uma solução a 15 %se sua densidade é 1,035 g/ml? Método 1. Reorganizando as fórmulas
Ambos os métodos demonstraram que a solução com densidade de 1,201 g/ml e volume de 20 ml tem massa de 24,02 g. Se conhecermos a densidade, podemos realizar ainda mais cálculos no contexto da concentração percentual. Exemplo 4. Quantos gramas de sal estão contidos em 10 ml de uma solução a 15 %se sua densidade é 1,035 g/ml? Método 1. Reorganizando as fórmulas 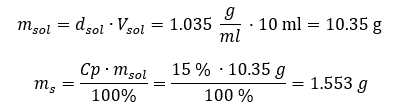 Método 2. Usando as proporções
Método 2. Usando as proporções 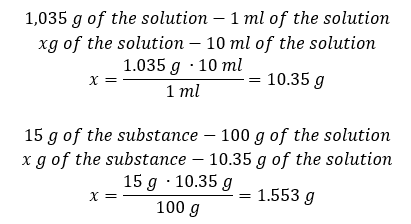 Ambos os métodos demonstraram que para preparar 10 ml de uma solução com Cp = 15%e densidade de 1,035 g/ml, temos que pesar 1,553 g de sal. Exemplo 5. Qual é a concentração percentual de uma solução produzida pela dissolução de 40 g de uma substância em 200 ml de etanol com densidade de 0,78 g/ml? Para fazer o cálculo, podemos usar a fórmula de concentração percentual. A massa da solução pode ser calculada somando as massas do soluto e do solvente. A massa do solvente é desconhecida, mas sabemos sua densidade e volume, então os dados que faltam podem ser calculados rearranjando a fórmula da densidade.
Ambos os métodos demonstraram que para preparar 10 ml de uma solução com Cp = 15%e densidade de 1,035 g/ml, temos que pesar 1,553 g de sal. Exemplo 5. Qual é a concentração percentual de uma solução produzida pela dissolução de 40 g de uma substância em 200 ml de etanol com densidade de 0,78 g/ml? Para fazer o cálculo, podemos usar a fórmula de concentração percentual. A massa da solução pode ser calculada somando as massas do soluto e do solvente. A massa do solvente é desconhecida, mas sabemos sua densidade e volume, então os dados que faltam podem ser calculados rearranjando a fórmula da densidade.