A dissociação, no contexto químico, significa a decomposição de uma substância em outras moléculas. A palavra vem do latim “ dissociatio ”, que significa “separação”. Na nomenclatura científica, a dissociação tem várias definições, pois também tem seu significado específico na psicologia. Mas vamos nos concentrar no que a dissociação significa em química. Dependendo do curso do processo e da substância utilizada, podemos distinguir quatro tipos diferentes de dissociação. O mais popular é a dissociação eletrolítica, embora a dissociação térmica seja igualmente importante.

dissociação térmica
O processo consiste na decomposição de moléculas em moléculas menores ou em átomos, sob a influência da temperatura. A relação mais importante é o fato de que a temperatura usada para a dissociação pode ser menor se o composto incluir ligações químicas mais fracas. Aqueles com maior energia necessária para a decomposição requerem uma temperatura mais alta. Um exemplo comum de termólise (dissociação térmica) é a caramelização da sacarose, que ocorre a 160 o C.
dissociação eletrolítica
Descoberto em 1887 pelo químico sueco Svante Arrhenius, é um pouco mais complexo em comparação com a dissociação térmica. A dissociação eletrolítica consiste na decomposição de uma substância, que ocorre quando um solvente (geralmente água) afeta íons em movimento livre. Arrhenius provou em sua pesquisa que os íons produzidos por tal dissociação fazem com que a solução conduza eletricidade. Esta foi a base para desenvolver a classificação de substâncias químicas em eletrólitos (soluções capazes de conduzir corrente elétrica) e não eletrólitos (soluções não capazes de conduzir corrente elétrica).
Eletrólitos
O termo “eletrólitos” tem dois significados – do ponto de vista técnico, é qualquer substância que pode transferir ionicamente uma carga entre eletrodos. Como resultado, pode conduzir corrente elétrica ionicamente. O outro significado mais químico desse termo refere-se a substâncias que sofrem dissociação eletrolítica como consequência da fusão ou dissolução. Essas soluções (na maioria das vezes aquosas) também conduzem eletricidade. Exemplos de tais eletrólitos incluem compostos iônicos, como cloreto de sódio (sal de cozinha), mas também compostos não iônicos, por exemplo, ácido clorídrico ou hidróxido de potássio . Dadas as suas propriedades específicas, os eletrólitos podem ser chamados de condutores elétricos. Estes podem ser divididos em condutores de classe 1 (metais, suas ligas e carbono) e condutores de classe 2 (soluções de bases, ácidos e sais ).
O mecanismo da dissociação eletrolítica
Em um solvente cuja constante dielétrica é alta (por exemplo, 81 para a água), as forças de atração mútua entre os íons em uma rede cristalina são consideravelmente reduzidas. É quando os íons se quebram, o que faz com que a substância se dissolva e segregue íons que se movem livremente na solução. Tais processos também ocorrem devido à interação entre íons e moléculas de água, consequência de uma estrutura polar da H 2 O. Segundo Nekrasov, o mecanismo de ação da água durante a decomposição de um eletrólito com estrutura iônica é iniciado por o íon positivo da substância, que atrai o pólo oposto da molécula de água, ao mesmo tempo que afasta o íon positivo. O pólo oposto age da mesma maneira, e ambos os íons ficam cercados pelas moléculas de água que atraíram. Essa atração ocorre em ambas as direções entre as moléculas dipolares e os íons, o que torna a força de atração dos íons no eletrólito muito menor. Assim, o mecanismo pode ser dividido em quatro estágios principais: a transição da estrutura polar para iônica, a formação da estrutura iônica e a hidratação dos íons. As ligações entre os íons e o solvente, produzidas por dissociação, são chamadas de solvatos. Se a água for o solvente, eles são chamados de hidratos.
A casca de hidratação
É uma casca composta de moléculas de água existentes nas proximidades do íon, orientadas com seus pólos opostos. Pólos livres e carregados atraem mais camadas de água, até que a força de atração do íon se torne mais fraca do que a energia do movimento molecular na solução. A casca facilita a decomposição das moléculas do eletrólito em cátions e ânions, e constitui uma barreira que dificulta a religação dos íons para formar moléculas. 
Dissociação de ácidos e bases: a lei da ação das massas
Ácidos fortes são os ácidos que mostram dissociação de longo alcance em uma solução aquosa, e ácidos fracos são aqueles que se dissociam apenas em pequena extensão. Se compararmos a força de diferentes ácidos, também devemos levar em consideração alguns fatores, como a tendência das moléculas de ácido de doar seus prótons ou a concentração da substância em questão. No entanto, existe um valor químico que não depende da concentração, mas caracteriza de forma excelente as propriedades individuais das moléculas – a constante de dissociação. Derivar a equação para esse valor deve começar escrevendo a equação para a dissociação ácida . Para um exemplo com um único próton (HX), ficará assim: ![]() Se a solução for diluída e o ácido for fraco, podemos aplicar a lei da ação das massas, que se expressa da seguinte forma:
Se a solução for diluída e o ácido for fraco, podemos aplicar a lei da ação das massas, que se expressa da seguinte forma: 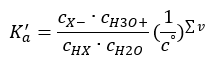 Existem duas maneiras de tornar o relacionamento apresentado mais curto. O primeiro passo é assumir que a concentração de água é constante. Também podemos omitir o símbolo c o , pois expressa uma concentração padrão igual a 1 mol/dm 3 . No entanto, é importante colocá-lo na fórmula inicial e levá-lo em consideração ao determinar a unidade. Isso ocorre porque as constantes químicas são valores adimensionais. Entretanto, todas as concentrações utilizadas na fórmula são expressas em mol/dm 3 . Então finalmente obtemos a fórmula para a constante de dissociação:
Existem duas maneiras de tornar o relacionamento apresentado mais curto. O primeiro passo é assumir que a concentração de água é constante. Também podemos omitir o símbolo c o , pois expressa uma concentração padrão igual a 1 mol/dm 3 . No entanto, é importante colocá-lo na fórmula inicial e levá-lo em consideração ao determinar a unidade. Isso ocorre porque as constantes químicas são valores adimensionais. Entretanto, todas as concentrações utilizadas na fórmula são expressas em mol/dm 3 . Então finalmente obtemos a fórmula para a constante de dissociação: 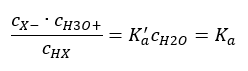 A relação que expressa a constante de dissociação ácida (K a ) consiste em valores determinados experimentalmente, que se situam na faixa de 10 -10 a 10 8 . Uma operação popular é usar uma fórmula logarítmica, expressa como um logaritmo negativo da constante de dissociação, designada como pK a : pK a = -logK a É importante que valores baixos de K a representem ácidos fracos e valores altos representem ácidos fortes , o pK a muda no sentido oposto. Valores de pKa baixos, geralmente negativos, correspondem a ácidos fortes. Valores de pKa altos e positivos representam ácidos fracos. Quando introduzimos outro conceito, o grau de dissociação (α), que é a razão entre o número de moles das moléculas de um determinado composto, que sofrem dissociação (decomposição em íons), para o número total de moles das moléculas de esse composto, presente na solução, podemos desenvolver ainda mais a equação. Se desconsiderarmos a concentração muito baixa de íons de hidrogênio formados pela dissociação da água e usarmos as concentrações de equilíbrio de íons e moléculas, podemos supor que:
A relação que expressa a constante de dissociação ácida (K a ) consiste em valores determinados experimentalmente, que se situam na faixa de 10 -10 a 10 8 . Uma operação popular é usar uma fórmula logarítmica, expressa como um logaritmo negativo da constante de dissociação, designada como pK a : pK a = -logK a É importante que valores baixos de K a representem ácidos fracos e valores altos representem ácidos fortes , o pK a muda no sentido oposto. Valores de pKa baixos, geralmente negativos, correspondem a ácidos fortes. Valores de pKa altos e positivos representam ácidos fracos. Quando introduzimos outro conceito, o grau de dissociação (α), que é a razão entre o número de moles das moléculas de um determinado composto, que sofrem dissociação (decomposição em íons), para o número total de moles das moléculas de esse composto, presente na solução, podemos desenvolver ainda mais a equação. Se desconsiderarmos a concentração muito baixa de íons de hidrogênio formados pela dissociação da água e usarmos as concentrações de equilíbrio de íons e moléculas, podemos supor que: 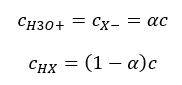 Então a constante de dissociação pode ser anotada como segue:
Então a constante de dissociação pode ser anotada como segue:  Nesta forma, é a dependência do grau de dissociação de um eletrólito de sua concentração, ou seja, a lei da diluição de Ostwald. Se analisarmos eletrólitos muito fracos, o grau de dissociação (α) pode ser assumido como <<1, e a fórmula pode ser simplificada para o seguinte:
Nesta forma, é a dependência do grau de dissociação de um eletrólito de sua concentração, ou seja, a lei da diluição de Ostwald. Se analisarmos eletrólitos muito fracos, o grau de dissociação (α) pode ser assumido como <<1, e a fórmula pode ser simplificada para o seguinte:  Ácidos que contêm mais de um próton sofrem dissociação em vários estágios, e devemos levar em consideração todos os seus estágios. Para dar um exemplo, para o ácido ortofosfórico existem três estágios:
Ácidos que contêm mais de um próton sofrem dissociação em vários estágios, e devemos levar em consideração todos os seus estágios. Para dar um exemplo, para o ácido ortofosfórico existem três estágios:
- H 3 PO 4 + H 2 O = H 2 PO 4 – + H 3 O +
- H 2 PO 4 – + H 2 O = HPO 4 2- + H 3 O +
- HPO 4 2- + H 2 O = PO 4 3- + H 3 O +
Cada estágio tem sua própria constante de equilíbrio, que pode ser observada de forma análoga à primeira:  As constantes de dissociação são tabuladas, tanto para hidrácidos quanto para oxiácidos.
As constantes de dissociação são tabuladas, tanto para hidrácidos quanto para oxiácidos.
| Ácido | Ka | pK a |
| HF | 6,3·10 -4 | 3.2 |
| HCl | 1·10 7 | -7 |
| HNO 3 | 27.54 | -1,44 |
| H 3 PO 4 | 6,9·10 -3 | 2.16 |
Tabela 1. Valores de exemplo de constantes de dissociação para ácidos. É semelhante para a estabilização do equilíbrio de bases durante a dissociação. Considerando o exemplo da regra B, a equação pode ser notada da seguinte forma: ![]() Então, se quisermos derivar uma constante de dissociação para uma base, usando a lei de ação das massas e assumindo que a concentração de água na solução diluída é praticamente constante, obtemos a seguinte fórmula:
Então, se quisermos derivar uma constante de dissociação para uma base, usando a lei de ação das massas e assumindo que a concentração de água na solução diluída é praticamente constante, obtemos a seguinte fórmula:  Quanto mais forte a base, maior a constante de dissociação e menor o valor de pKb , enquanto quanto menor a constante de dissociação e maior o valor de pKb , mais fraca é a base.
Quanto mais forte a base, maior a constante de dissociação e menor o valor de pKb , enquanto quanto menor a constante de dissociação e maior o valor de pKb , mais fraca é a base.
| Base | K b | pK b |
| hidrazina | 3·10 -6 | 5.5 |
| Amônia | 1,78·10 -5 | 4,75 |
| Metilamina | 5,0·10 -4 | 3.3 |
Tabela 2. Valores de exemplo de constantes de dissociação para bases. 
O que determina a força dos ácidos
Se conhecermos as expressões das constantes de dissociação para determinados ácidos, podemos fazer algumas suposições verdadeiras:
- A força de um hidrácido aumenta junto com o aumento do número atômico do elemento ligado ao átomo de hidrogênio.
- A força de um hidrácido diminui junto com o aumento da eletronegatividade do elemento ligado ao átomo de hidrogênio. Isso pode ser enganoso, pois em teoria a eletronegatividade crescente deveria favorecer a abstração de prótons.
- O tamanho do ânion formado durante a dissociação afeta a constante de dissociação em maior extensão do que a eletronegatividade.
Autodissociação da água
Um exemplo interessante de dissociação é a decomposição de moléculas de água. Como são capazes tanto de atrair prótons quanto de distribuí-los, a água pura sofre uma pequena autodissociação, conforme a seguinte equação: H 2 O + H 2 O ↔ H 3 O + + OH – Como para ácidos e bases, também é possível aplicar a lei de ação das massas, que inclui concentrações de equilíbrio de água não dissociada, bem como seus ânions e cátions: 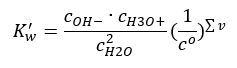 Acontece que as concentrações de cátions H 3 O + e ânions OH – são tão pequenas em comparação com a água não dissociada que mesmo sua alteração praticamente não altera a concentração de água não dissociada. Isso permite assumir que esse valor é constante e converter a equação para a seguinte forma: K w = c OH – · c H3O + É um aspecto particularmente importante no contexto de cálculos químicos, e tal constante é referida como o produto iônico da água. Também é frequentemente usado como um logaritmo negativo, designado como pK w . Isso é igual a –logK w . Com base na equação, se o equilíbrio iônico da água for perturbado como resultado do fornecimento de íons H 3 O + , então, para manter a constância do produto iônico, devemos reduzir a concentração de íons OH – . Da mesma forma, um excesso de íons OH – reduz a concentração de cátions. O produto dessas concentrações deve ser constante. Experimentos mostraram que K w a uma temperatura de 298 K é 10 -14 . Portanto, podemos observar também a equação válida para água pura da seguinte forma:
Acontece que as concentrações de cátions H 3 O + e ânions OH – são tão pequenas em comparação com a água não dissociada que mesmo sua alteração praticamente não altera a concentração de água não dissociada. Isso permite assumir que esse valor é constante e converter a equação para a seguinte forma: K w = c OH – · c H3O + É um aspecto particularmente importante no contexto de cálculos químicos, e tal constante é referida como o produto iônico da água. Também é frequentemente usado como um logaritmo negativo, designado como pK w . Isso é igual a –logK w . Com base na equação, se o equilíbrio iônico da água for perturbado como resultado do fornecimento de íons H 3 O + , então, para manter a constância do produto iônico, devemos reduzir a concentração de íons OH – . Da mesma forma, um excesso de íons OH – reduz a concentração de cátions. O produto dessas concentrações deve ser constante. Experimentos mostraram que K w a uma temperatura de 298 K é 10 -14 . Portanto, podemos observar também a equação válida para água pura da seguinte forma:  A dissociação também está relacionada ao valor de pH da solução. Soluções com concentrações iguais de cátions H 3 O + e ânions OH – apresentam um pH neutro. Em soluções ácidas a concentração de cátions é maior que 10 -7 mol/l, enquanto em soluções alcalinas é menor que 10 -7 mol/l.
A dissociação também está relacionada ao valor de pH da solução. Soluções com concentrações iguais de cátions H 3 O + e ânions OH – apresentam um pH neutro. Em soluções ácidas a concentração de cátions é maior que 10 -7 mol/l, enquanto em soluções alcalinas é menor que 10 -7 mol/l.
