Os métodos espectroscópicos são um grupo de métodos em que o sinal é produzido pela interação da radiação eletromagnética ou corpuscular com a amostra examinada. Esta radiação pode surgir como resultado de mudanças periódicas no campo eletromagnético associado à transferência de energia. Esses métodos são usados para determinar a concentração ou conteúdo de átomos em um determinado sistema absorvente ou emissor. Que tipos de espectrofotometria existem e o que esses métodos envolvem? Isso é o que você descobrirá em nosso artigo.

Transições de radiação e energia
A propriedade mais importante dos fótons, ou quanta de radiação, é a energia. A fórmula do valor energético (E) é o produto da constante de Planck (h) de 6,626·10 -34 [J ·s] e da frequência de radiação (v) expressa em Hertz [Hz]. 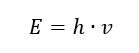 A espectrofotometria utiliza transições de energia nas moléculas, causadas pela absorção ou emissão de radiação eletromagnética em diferentes faixas:
A espectrofotometria utiliza transições de energia nas moléculas, causadas pela absorção ou emissão de radiação eletromagnética em diferentes faixas:
- ultravioleta (UV) 200-380 nm,
- radiação visível (Vis) 380-780 nm,
- infravermelho próximo (IR) 0,78-30000 μm.
Conceitos básicos e leis da espectrofotometria
Ponto isosbéstico
Este é o ponto correspondente a um comprimento de onda específico resultante da intersecção de curvas traçadas no sistema absorbância-comprimento de onda, onde ambas as formas do composto em solução (dissociadas e indissociadas) apresentam absorção igual. Uma mudança no pH não altera a posição, um composto pode ter muitos desses pontos.
Espectro de absorção de um composto químico
O espectro é uma medida da quantidade de luz absorvida pelo composto a partir do comprimento de onda da luz (λ). Se a radiação eletromagnética (luz) de intensidade I 0 incidir sobre uma amostra, parte dessa radiação será absorvida e parte passará através da amostra. Registrando as intensidades da radiação incidente (I 0 ) e transmitida (I t ), podemos determinar a quantidade de luz que é absorvida pela solução (absorbância, A), ou que passou por ela (transmitância, T).
Absorvância
A quantidade que descreve o fenômeno da absorção é a absorbância. Esta é uma medida adimensional da intensidade da radiação eletromagnética em relação ao número de átomos livres. Este valor foi introduzido para facilitar os cálculos relacionados aos volumes de absorção. A absorção é a interação entre a radiação eletromagnética e a matéria – a absorção de parte da energia pela matéria. A absorvância é aditiva e às vezes é chamada de densidade óptica. Simbolicamente, é registrado como Abs ou A. Matematicamente, é o logaritmo decimal da razão entre a intensidade do feixe de radiação incidente na amostra de teste (I 0 ) e a intensidade do feixe de radiação transmitido através da amostra de teste. ( Isto ). Pode assumir valores de 0 a infinito. A expressão matemática que descreve esta relação é chamada lei de Beer-Lambert. A absorvância num determinado comprimento de onda depende do coeficiente de absorção (ε), da espessura da camada absorvente (geralmente 1 cm) e da concentração da solução de teste.
Transmitância
Transmitância é a razão entre a irradiância que passa pela amostra (I t ) e a irradiância incidente na amostra (I 0 ), que é igual à irradiância que passa pela referência. Na maioria das vezes é expresso como uma porcentagem e pode variar de 0%a 100%. É expresso pela fórmula: 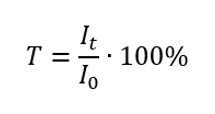 A relação entre absorbância e transmitância é expressa da seguinte forma:
A relação entre absorbância e transmitância é expressa da seguinte forma: 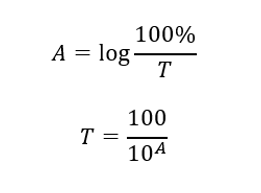
Lei de Lambert
Diz que a absorbância é proporcional à espessura da camada absorvente de uma amostra homogênea. Pode ser registrado como o quociente do coeficiente de absorção (k) e a espessura da camada de amostra medida (l): 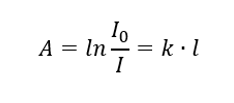

Lei Beer-Lambert
Diz respeito à absorção de radiação por soluções e pode ser formulado da seguinte forma: se o coeficiente de absorção do solvente for zero, então a absorbância de um feixe de radiação monocromática que passa por uma solução homogênea é diretamente proporcional à concentração (c) da solução e à espessura da camada absorvente (l). A lei de Beer-Lambert é a definição de absorbância e pode ser escrita da seguinte forma: 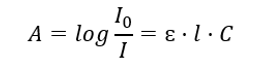 O coeficiente de absorção molar (ɛ) é um valor característico de uma substância em um solvente específico e em um comprimento de onda específico. É proporcional à probabilidade de transições entre os níveis de energia da molécula e depende diretamente da energia dos fótons de radiação. Em termos numéricos, representa a absorbância apresentada por uma solução com concentração de 1 mol/dm 3 , com espessura de camada absorvente de 1 cm. O conhecimento do coeficiente permite determinar a concentração da solução de teste após medir a magnitude da absorbância. Opcionalmente, a absorvância esperada da solução também pode ser calculada a partir do coeficiente e da concentração. A fórmula é usada principalmente para determinar a concentração de uma substância com um coeficiente de absorção molar conhecido e uma absorvância medida empiricamente. Isto pode ser feito utilizando uma fórmula ou traçando uma curva de calibração para a substância em vários pontos da faixa de concentração esperada. A lei de Beer-Lambert também pode ser apresentada como dependência de absorção da concentração: A = f(C).
O coeficiente de absorção molar (ɛ) é um valor característico de uma substância em um solvente específico e em um comprimento de onda específico. É proporcional à probabilidade de transições entre os níveis de energia da molécula e depende diretamente da energia dos fótons de radiação. Em termos numéricos, representa a absorbância apresentada por uma solução com concentração de 1 mol/dm 3 , com espessura de camada absorvente de 1 cm. O conhecimento do coeficiente permite determinar a concentração da solução de teste após medir a magnitude da absorbância. Opcionalmente, a absorvância esperada da solução também pode ser calculada a partir do coeficiente e da concentração. A fórmula é usada principalmente para determinar a concentração de uma substância com um coeficiente de absorção molar conhecido e uma absorvância medida empiricamente. Isto pode ser feito utilizando uma fórmula ou traçando uma curva de calibração para a substância em vários pontos da faixa de concentração esperada. A lei de Beer-Lambert também pode ser apresentada como dependência de absorção da concentração: A = f(C).
Lei da aditividade
A lei Beer-Lambert refere-se ao caso em que existe uma substância absorvente em solução. Contudo, se existirem mais substâncias numa solução multicomponente que absorvem radiação num comprimento de onda seleccionado, a absorvância desta solução (A) é igual à soma das absorvâncias dos seus componentes individuais (A 1 , A 2 ,…), ou seja A=A 1 +A 2 +⋯+A n . Vale ressaltar e lembrar que a absorbância de cada componente é o produto de sua concentração e o correspondente coeficiente de absorção molar. Esta é a 3ª lei da absorção, utilizada na análise espectrofotométrica de sistemas multicomponentes.
Desvios das leis de absorção
Um pré-requisito para cumprir as leis de absorção é que a radiação que atua no sistema seja monocromática e que sua intensidade não seja muito alta. As razões para se desviar da lei Beer-Lambert podem ser:
- imperfeição dos instrumentos de medição, resultando no não cumprimento da condição,
- reações químicas que ocorrem durante a medição, por exemplo polimerização , hidrólise, condensação,
- turbidez da solução.
Aplicação de espectros de absorção de elétrons
- Ele permite que o tipo de transições eletrônicas seja determinado examinando espectros em solventes de polaridades diferentes.
- As diferenças na posição e intensidade das bandas de absorção das diferentes formas moleculares são utilizadas para estudar os equilíbrios estabelecidos entre elas na solução ( estudos estruturais , equilíbrios tautoméricos).
- Usado para determinação de compostos com base na lei Beer-Lamber.
- Utilizado como método de identificação adicional com base na posição λ max das substâncias de teste.
- Usado na determinação da pureza dos compostos de teste – mudando a posição máxima de absorção, comparando a proporção dos valores de absorbância em dois pontos diferentes do espectro.

Espectroscopia eletrônica UV-Vis
Em termos do fenómeno de absorção, a espectrofotometria UV-Vis é uma técnica particularmente interessante, permitindo a análise qualitativa e quantitativa de muitas substâncias. O fenômeno de absorção de radiação é utilizado quando: a absorção depende linearmente da concentração ou quando a absorção é aditiva, ou seja, para uma solução multicomponente é a soma das absorções de seus componentes. As condições são atendidas quando não há interações intermoleculares no sistema. Ao analisar os espectros de absorção UV-Vis resultantes da passagem da radiação eletromagnética pela solução, são observadas transições dos elétrons de valência do estado fundamental para o estado excitado. Este fenômeno resulta na absorção de parte da radiação em determinados comprimentos de onda. A absorção é consequência da transição desses elétrons para níveis de energia mais elevados, mas para que isso aconteça, os quanta de radiação eletromagnética devem ter energia suficiente para equilibrar a diferença de energia entre os níveis de energia. Nas moléculas, essas energias são de alguns elétron-volts, o que corresponde precisamente à frequência UV-Vis.
Cromóforos
Compostos que apresentam absorção na faixa UV-Vis possuem cromóforos em sua estrutura, ou seja, grupos de átomos cujos elétrons são caracterizados por baixas energias de excitação. Por outras palavras, um cromóforo é a parte de uma molécula (grupo de átomos) responsável pela absorção selectiva da radiação na gama visível (180-800 nm) e, portanto, pela ocorrência da cor. Estes incluem: anéis aromáticos (sexteto de elétrons aromáticos), ligações múltiplas (parte delas – ligações do tipo π), tanto entre átomos de carbono quanto outras, como o grupo carbonila C=O.
Auxocromos
Outro grupo de átomos são os auxocromos, ou seja, substituintes que não apresentam absorção na faixa UV-Vis, mas sua presença provoca alterações nos espectros dos elementos absorventes. Eles potencializam a ação dos cromóforos, que muitas vezes podemos observar na forma de uma coloração muito mais intensa da substância em estudo do que no caso de sua ausência no sistema. Além disso, dividimos os auxocromos em batocromos , por exemplo –NH 2 , -OH, que deslocam o máximo de absorção para comprimentos de onda mais longos, e hipsocromos , como –CH 3 , -CO, que deslocam o máximo para comprimentos de onda mais curtos.
Espectroscopia de Absorção Atômica (AAS)
Esta é outra técnica que utiliza o fenômeno da absorção. É utilizado para determinar elementos químicos na forma de amostras em qualquer estado (líquido, sólido, gasoso) e a medição em si é baseada na observação da absorção de radiação de um comprimento de onda específico por átomos metálicos livres. A base da técnica é que um átomo só pode absorver radiação eletromagnética em um comprimento de onda no qual também pode emiti-la, e isso é característico apenas de um determinado elemento. Com maior energia fornecida ao átomo, os elétrons são excitados para níveis mais elevados e um maior número de linhas é observado no espectro. Se a energia fornecida corresponder ao potencial de ionização do átomo, formam-se íons como o Na + . A base para a análise quantitativa por espectrometria de absorção atômica é a proporcionalidade da absorbância ao número de átomos absorventes e a lei de Beer-Lambert.
