A estequiometria é o ramo da química geral que trata dos cálculos relativos ao curso quantitativo das reações químicas. Ao trabalhar em laboratório, muitas vezes é necessário saber quanto (massa, volume, moléculas) de substratos precisamos utilizar para que a reação química que estamos realizando ocorra completamente ou para obter a quantidade de produto nós queremos. Às vezes também é necessário calcular o excesso ou a falta de substrato que fez com que o experimento fosse executado de forma diferente do esperado. Cada um desses cálculos segue diretamente da interpretação quantitativa da equação da reação química e utiliza as leis de conservação da massa. Esses tipos de equações são chamados de cálculos estequiométricos.

O que precisamos saber?
Para usar a estequiometria, precisamos ter conhecimento em diversas áreas, incluindo: equações de reações químicas, coeficientes estequiométricos, massas molares e molares e volumes molares de gases e lei de Avogadro . Utilizando o conhecimento da estequiometria das reações químicas, muitos problemas de cálculo podem ser resolvidos, tais como:
- Análise Elemental,
- cálculos molares,
- cálculos de massa,
- cálculo de misturas não estequiométricas com possibilidade de determinação da substância limitante da reação,
- rendimento da reação.
Massa molar
Devido à massa inconcebivelmente pequena de átomos e moléculas individuais, a unidade (u) , que expressa a massa atômica, foi criada. Na prática, este é um valor igual a 1/12 da massa do isótopo de carbono 12 C. Esta porção de uma substância está intimamente relacionada com a constante de Avogadro e é determinada como o número de gramas de uma substância que contém 6,022·10 23 átomos, moléculas ou íons. A massa molar [M] é numericamente igual à massa atômica ou molecular e a unidade é g/mol.
Volume molar da substância [Vm]
Este é um valor específico da substância que depende fortemente das condições de temperatura e pressão. Este é o volume da substância ocupado por um mol dela. Em condições normais, adota-se um valor constante de 22,4 dm 3 .
Lei da composição constante e conservação da massa
Todo composto químico, independentemente de sua origem e método de obtenção, possui composição qualitativa e quantitativa bem definida e constante. O óxido de enxofre (IV), por exemplo, sempre contém 50%em peso de enxofre e o óxido de enxofre (VI) 40%em peso deste elemento. Num sistema fechado, a massa dos produtos resultantes é igual à massa dos substratos consumidos durante a reação. A lei da conservação da massa reflete-se na necessidade de equilibrar cada equação de reação química com os coeficientes químicos apropriados para que os dois lados da equação sejam iguais em termos do número de átomos presentes. As razões estequiométricas refletem as razões molares dos reagentes presentes na reação química.
Equação de reação química
Todas as informações necessárias sobre as relações relativas entre substâncias químicas são derivadas de sua equação de reação química. Ele fornece algumas informações relativas e quantitativas importantes.
Exemplo 1.
Da equação para a síntese da amônia , que segue a reação: ![]() podemos realizar diversas interpretações – moleculares, molares, massas molares, volumes molares e números moleculares. a) Molecularmente, podemos ler que três moléculas de hidrogênio reagem com uma molécula de nitrogênio para formar duas moléculas de amônia. b) Isto também significa que três moles de hidrogênio reagem com um mol de nitrogênio para formar o produto de dois moles de amônia. c) Utilizando a tabela periódica dos elementos químicos , que contém as massas molares dos átomos individuais, também podemos concluir da equação que 6 g de hidrogénio reagiram completamente com 28 g de azoto para formar 34 g de amoníaco. d) Então, assumindo condições normais, sabemos que um mol de gás ocupa 22,4 dm 3 . Isso nos permite concluir que 67,2 dm 3 de hidrogênio reagem com 22,4 dm 3 de nitrogênio para formar 44,8 dm 3 de amônia. e) Outra relação útil é a lei de Avogadro, que afirma que volumes iguais de gases diferentes contêm o mesmo número de partículas sob as mesmas condições de pressão e temperatura. Conhecendo a constante de Avogadro de 6,022·10 23 , sabemos que precisamos de 3·6,022·10 23 moléculas de hidrogênio e 6,022·10 23 moléculas de nitrogênio para realizar a reação química completa para a síntese de amônia. A reação produz 2·6,022·10 23 moléculas de amônia.
podemos realizar diversas interpretações – moleculares, molares, massas molares, volumes molares e números moleculares. a) Molecularmente, podemos ler que três moléculas de hidrogênio reagem com uma molécula de nitrogênio para formar duas moléculas de amônia. b) Isto também significa que três moles de hidrogênio reagem com um mol de nitrogênio para formar o produto de dois moles de amônia. c) Utilizando a tabela periódica dos elementos químicos , que contém as massas molares dos átomos individuais, também podemos concluir da equação que 6 g de hidrogénio reagiram completamente com 28 g de azoto para formar 34 g de amoníaco. d) Então, assumindo condições normais, sabemos que um mol de gás ocupa 22,4 dm 3 . Isso nos permite concluir que 67,2 dm 3 de hidrogênio reagem com 22,4 dm 3 de nitrogênio para formar 44,8 dm 3 de amônia. e) Outra relação útil é a lei de Avogadro, que afirma que volumes iguais de gases diferentes contêm o mesmo número de partículas sob as mesmas condições de pressão e temperatura. Conhecendo a constante de Avogadro de 6,022·10 23 , sabemos que precisamos de 3·6,022·10 23 moléculas de hidrogênio e 6,022·10 23 moléculas de nitrogênio para realizar a reação química completa para a síntese de amônia. A reação produz 2·6,022·10 23 moléculas de amônia.
Exemplo 2.
A reação de combustão do magnésio em cloro ocorre de acordo com a equação: ![]() nos permite chegar a interpretações semelhantes ao exemplo anterior. a) Ainda à primeira vista, a equação apresentada permite-nos concluir que, para obtermos uma molécula de cloreto de magnésio , devemos fornecer como substratos uma molécula de magnésio e uma molécula de cloro. b) Isto é obviamente equivalente ao número de moles presentes no sistema, ou seja, um mol de magnésio, um mol de cloro, um mol de cloreto de magnésio. c) Para cálculos de massa, sabemos que 24 g de magnésio reagem com 71 g de cloro para formar 95 g de cloreto de magnésio. d) Como apenas um gás, o cloro , está envolvido na reação química em consideração, também podemos escrever para ele que ocupa um volume de 22,4 dm 3 . e) Nas contagens de partículas, cada componente é igual ao outro e assume o valor 6,022·10 23 .
nos permite chegar a interpretações semelhantes ao exemplo anterior. a) Ainda à primeira vista, a equação apresentada permite-nos concluir que, para obtermos uma molécula de cloreto de magnésio , devemos fornecer como substratos uma molécula de magnésio e uma molécula de cloro. b) Isto é obviamente equivalente ao número de moles presentes no sistema, ou seja, um mol de magnésio, um mol de cloro, um mol de cloreto de magnésio. c) Para cálculos de massa, sabemos que 24 g de magnésio reagem com 71 g de cloro para formar 95 g de cloreto de magnésio. d) Como apenas um gás, o cloro , está envolvido na reação química em consideração, também podemos escrever para ele que ocupa um volume de 22,4 dm 3 . e) Nas contagens de partículas, cada componente é igual ao outro e assume o valor 6,022·10 23 . 
Rendimento percentual da reação química [%W]
Cálculos estequiométricos também são usados para descobrir o rendimento de uma reação, ou seja, a razão entre a quantidade real de produto obtida e a quantidade derivada da equação da reação química.
Exemplo 1.
Foi realizada a reação de oxidação de 30 kg de óxido de enxofre (IV) e, na presença de um catalisador de platina, o produto obtido foi 34 kg de óxido de enxofre (VI). Qual foi o rendimento desse processo? Equação de reação química: ![]() A partir da reação registrada, podemos ver que dois moles de óxido de enxofre (IV) produzem a mesma quantidade de moles de óxido de enxofre (VI). Conhecendo as massas molares dos reagentes, sabemos que estequiometricamente, assumindo um rendimento de 100%, 128 g de SO 2 produzem 160 g de SO 3 . Com esse conhecimento, podemos organizar a proporção: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 A partir daqui descobriremos a quantidade de óxido de enxofre (VI) que seria produzida a 100 por cento colheita.
A partir da reação registrada, podemos ver que dois moles de óxido de enxofre (IV) produzem a mesma quantidade de moles de óxido de enxofre (VI). Conhecendo as massas molares dos reagentes, sabemos que estequiometricamente, assumindo um rendimento de 100%, 128 g de SO 2 produzem 160 g de SO 3 . Com esse conhecimento, podemos organizar a proporção: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 A partir daqui descobriremos a quantidade de óxido de enxofre (VI) que seria produzida a 100 por cento colheita. 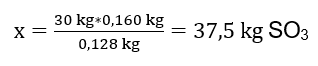 Conhecendo a quantidade teórica e real de SO 3 , podemos calcular o rendimento com que ocorreu a reação. 37,5 kg SO 3 – 100 %de rendimento 34 kg SO 3 – x %de rendimento
Conhecendo a quantidade teórica e real de SO 3 , podemos calcular o rendimento com que ocorreu a reação. 37,5 kg SO 3 – 100 %de rendimento 34 kg SO 3 – x %de rendimento 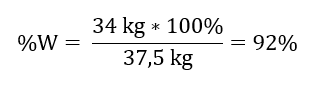 A oxidação do óxido de enxofre (IV) a óxido de enxofre (VI) utilizando um catalisador de platina ocorreu com rendimento de 92%.
A oxidação do óxido de enxofre (IV) a óxido de enxofre (VI) utilizando um catalisador de platina ocorreu com rendimento de 92%.
Fórmulas moleculares e elementares
Outra aplicação dos cálculos estequiométricos é determinar as fórmulas de compostos químicos simples. A fórmula molecular de um composto químico é idêntica ou um múltiplo inteiro da fórmula empírica. Se soubermos que a fórmula geral de um composto químico é N x O y , os valores dos índices estequiométricos podem ser calculados dividindo a massa por átomos pelas suas massas atómicas. Se o peso molecular de um composto químico não for conhecido, mas apenas a sua composição percentual, apenas a fórmula elementar poderá ser fornecida. Pode ser uma representação verdadeira da fórmula molecular ou simplesmente determinar a proporção dos elementos individuais.
Exemplo 1.
O peso molecular do composto químico é 92 u e consiste em 30,43 %de nitrogênio e 69,57 %de oxigênio. Qual é a fórmula molecular do composto químico? Como a soma das moléculas presentes no composto é 100%podemos assumir que: 92 u – 100%Isso nos permite calcular os conteúdos elementares individuais: 92 u – 100%xu de nitrogênio – 30,43%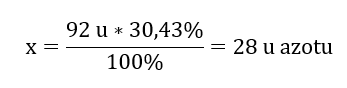 Portanto sabemos que a massa por átomo de oxigênio é: 92 u – 28 u = 64 u Conhecendo as massas individuais dos elementos, podemos determinar os índices estequiométricos:
Portanto sabemos que a massa por átomo de oxigênio é: 92 u – 28 u = 64 u Conhecendo as massas individuais dos elementos, podemos determinar os índices estequiométricos: 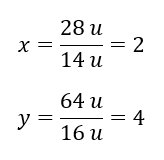 A fórmula molecular deste composto químico é N 2 O 4 .
A fórmula molecular deste composto químico é N 2 O 4 .
Exemplo 2.
Existem dois elementos no composto químico – oxigênio a 60%e enxofre a 40%. Qual é a sua fórmula elementar? A fórmula geral é S x O y , onde x é 40%e y é 60%. Conhecendo as massas molares dos elementos individuais, isso pode ser representado da seguinte forma: 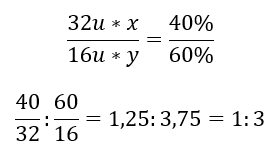 Isso significa que em um determinado composto químico existem três átomos de oxigênio para cada átomo de enxofre. A fórmula elementar é SO 3 .
Isso significa que em um determinado composto químico existem três átomos de oxigênio para cada átomo de enxofre. A fórmula elementar é SO 3 . 
Excesso e substrato limitante
No caso de reações em que os reagentes estão presentes em proporções divergentes da sua estequiometria correspondente, um dos reagentes reagirá completamente e a reação irá parar. Ele estará então presente na forma de reagente limitante, enquanto o segundo reagente estará em excesso no sistema e também ainda estará presente no sistema em sua forma primária quando a reação estiver completa.
Exemplo 1.
No laboratório, 40 cm 3 de uma solução 0,25 M de sulfato de alumínio reagiram com 50 cm 3 de uma solução 0,5 M de cloreto de bário. Quantos gramas de precipitado serão formados? Equação de reação química: ![]() O primeiro passo para conhecer o curso real de uma reação é determinar o número real de moles das substâncias envolvidas na reação. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol A segunda etapa é determinar o substrato deficitário com base na estequiometria da reação – isso determinará a quantidade de precipitado formado. 1mol Al 2 (SO 4 ) 3 – 3 mol BaCl 2 0,010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2
O primeiro passo para conhecer o curso real de uma reação é determinar o número real de moles das substâncias envolvidas na reação. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol A segunda etapa é determinar o substrato deficitário com base na estequiometria da reação – isso determinará a quantidade de precipitado formado. 1mol Al 2 (SO 4 ) 3 – 3 mol BaCl 2 0,010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2 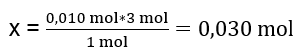 Para realizar a reação completamente, tendo 0,010 mol de Al 2 (SO 4 ) 3 , é necessário adicionar 0,030 mol de BaCl 2 ao sistema. No entanto, apenas 0,025 mol de cloreto de bário reagem, o que significa que está em défice e limitará a reacção. Portanto, a quantidade de precipitado formado na reação deve ser calculada a partir da quantidade deste substrato. O número de mols de cloreto de bário utilizado de acordo com a estequiometria da reação é igual ao número de mols do precipitado formado, assim: n BaSO4 = n BaCl2 0,025mol BaSO 4 = 0,025mol BaCl 2 Conhecendo o número de mols de bário sulfato, podemos calcular sua massa: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g As reações e quantidades de substratos dadas na tarefa produzem 5,835g de precipitado de sulfato de bário.
Para realizar a reação completamente, tendo 0,010 mol de Al 2 (SO 4 ) 3 , é necessário adicionar 0,030 mol de BaCl 2 ao sistema. No entanto, apenas 0,025 mol de cloreto de bário reagem, o que significa que está em défice e limitará a reacção. Portanto, a quantidade de precipitado formado na reação deve ser calculada a partir da quantidade deste substrato. O número de mols de cloreto de bário utilizado de acordo com a estequiometria da reação é igual ao número de mols do precipitado formado, assim: n BaSO4 = n BaCl2 0,025mol BaSO 4 = 0,025mol BaCl 2 Conhecendo o número de mols de bário sulfato, podemos calcular sua massa: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g As reações e quantidades de substratos dadas na tarefa produzem 5,835g de precipitado de sulfato de bário.
