Na química, alguns compostos químicos formam ligações especiais com moléculas de água. Estas não são ligações químicas, mas interações de curto alcance que determinam especificamente as propriedades desses compostos. Estamos falando de hidratos. Suas propriedades são facilmente utilizadas em setores industriais selecionados. O sal hidratado mais popular é, sem dúvida, o gesso, ou sulfato de cálcio di-hidratado (VI), que é uma importante matéria-prima na indústria da construção. Os hidratos também são indicadores muito bons do teor de umidade. Isto está relacionado com o facto de a cor do sal anidro ser muitas vezes diferente da do sal hidratado.

Hidrata
Os hidratos não são compostos químicos nos quais ocorrem ligações químicas , como ligações covalentes , entre as moléculas de água e as moléculas de um determinado sal . Eles também não são compostos de coordenação. A formação de ligações de hidrogênio, que são muito mais fracas em força do que as ligações químicas, é característica dessas estruturas. Os hidratos são estruturados na forma de uma rede cristalina. As moléculas de água estão distribuídas irregularmente nele. O termo “água de cristalização” é frequentemente utilizado. Os hidratos são obtidos por hidratação . As moléculas de sal, especialmente os derivados de ácidos inorgânicos, têm maior probabilidade de sofrer esta reação. A hidratação envolve a transformação de cristais anidros em hidratados. Pode causar alteração na massa mineral, mas não a destrói. A hidratação geralmente acompanha outros processos, como a carbonatação. Os produtos químicos de hidratação, em condições normais, são caracterizados por uma alta higroscopicidade , ou seja, uma forte afinidade pelas moléculas de água. Tais substâncias são capazes, por exemplo, de absorver a umidade do ar . Outra forma de obter hidratos é cristalizá-los a partir de soluções aquosas. As fórmulas moleculares dos hidratos são formadas anotando a fórmula do sal e informando o número de moléculas de água hidratadas. Para fornecer uma notação geral, a letra ‘n’ é colocada antes de ‘H 2 O’. Seus valores são maiores que um e correspondem ao número de moléculas de água ligadas. As distinções mais comuns são entre hidratos com n=½ (hemihidrato), n= 1 (monohidrato), n=2 (dihidrato) e n=3 (trihidrato). É importante ressaltar que a mesma substância pode anexar diferentes números de moléculas de água. ![]()
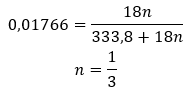 Dado que existem ligações de hidrogénio entre as moléculas de sal e as moléculas de água, estes compostos não apresentam resistência satisfatória a temperaturas elevadas. Quando aquecidos, eles se desintegram e mudam para formas anidras. Os hidratos dissolvem-se muito bem em água. Em soluções aquosas, são liberadas moléculas de água hidratada ligadas ao sal. Este fato deve ser levado em consideração, por exemplo, na elaboração de soluções dessas substâncias. A não consideração do grau de hidratação de um determinado composto resulta em erros, mesmo que apenas na determinação da concentração da solução. Uma característica importante dos sais hidratados é a mudança de cor devido à ligação de moléculas de água na reação de hidratação. Deve-se notar que as formas hidratadas apresentam significativamente menos higroscopicidade em comparação com os sais anidros.
Dado que existem ligações de hidrogénio entre as moléculas de sal e as moléculas de água, estes compostos não apresentam resistência satisfatória a temperaturas elevadas. Quando aquecidos, eles se desintegram e mudam para formas anidras. Os hidratos dissolvem-se muito bem em água. Em soluções aquosas, são liberadas moléculas de água hidratada ligadas ao sal. Este fato deve ser levado em consideração, por exemplo, na elaboração de soluções dessas substâncias. A não consideração do grau de hidratação de um determinado composto resulta em erros, mesmo que apenas na determinação da concentração da solução. Uma característica importante dos sais hidratados é a mudança de cor devido à ligação de moléculas de água na reação de hidratação. Deve-se notar que as formas hidratadas apresentam significativamente menos higroscopicidade em comparação com os sais anidros.
Hidratos de compostos inorgânicos
Os sais de ácidos inorgânicos são substâncias com maior probabilidade de formar hidratos com moléculas de água. Os hidratos mais comuns de compostos inorgânicos incluem:
- Hidrato de sulfato de cobre (II) (VI), CuSO 4 – sulfato de cobre (II) (VI) adota vários graus de hidratação. O número máximo de moléculas de água ligadas é cinco. Como resultado do aquecimento do penta-hidrato deste sal, as moléculas de água são removidas. Os primeiros dois e um tri-hidrato são formados e, com aquecimento adicional do sistema, o sulfato de cobre (II) mono-hidratado (VI) pode ser obtido. Para remover a última molécula de água, é necessário aquecer o composto a uma temperatura superior a 200 ᵒC. Os hidratos de sulfato de cobre (II) (VI) são de cor azul, causada pela presença de água de cristalização ao redor dos íons de cobre. Já o sal anidro é de cor branca. Sua alta higroscopicidade e capacidade de formar hidratos são utilizadas para remover a umidade de alguns líquidos.
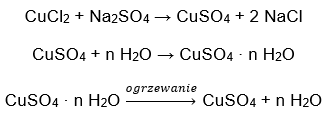
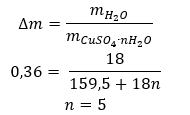
- O hidrato de cloreto de cobalto (II), CoCl 2 – cloreto de cobalto (II) anidro é altamente higroscópico. Graças à sua forte afinidade pelas moléculas de água, é capaz de absorver a umidade até do ar. Esse processo resulta na formação de hidratos desse sal. A forma hidratada mais comum é o cloreto de cobalto (II) hexahidratado – CoCl 2 * 6H 2 Outra forma é a molécula di-hidratada. Este sal também apresenta a capacidade de mudar de cor dependendo do seu teor de umidade. O sal anidro é azul, o di-hidrato assume uma cor púrpura rosada e a cor da molécula de hexa-hidrato é vermelho intenso.
- Hidrato de sulfato de sódio (VI), Na 2 SO 4 – este sal existe na forma de dois hidratos: heptahidratado (cinco moléculas de água na estrutura) e decaidrato (dez moléculas de água na estrutura). A forma anidra do sulfato de sódio (VI) ocorre na natureza como o raro mineral thénardita. O sulfato de sódio dez-hidratado (VI) é o chamado sal de Glauber. É amplamente utilizado na produção de vidro, papel, sabão em pó e refrigerante. O sal de Glauber também é um dos ingredientes necessários para a produção do pigmento azul ultramarino. Além disso, o composto tem efeito terapêutico no sistema digestivo, devido às suas propriedades laxantes.

Gesso
Um exemplo de hidrato de sal inorgânico de importância global e ampla aplicação é o gesso. É um mineral constituído pela forma hidratada do sulfato de cálcio (VI), CaSO 4 . O gesso cristalino é o di-hidrato deste sal. Em condições naturais, forma-se durante a evaporação da água salgada de lagos e rios, em temperaturas abaixo de 42ᵒC. O sulfato de cálcio anidro (VI) é anidrita. Também é conhecido como gesso anidro. O gesso para construção, por outro lado, é o sulfato de cálcio hemi-hidratado (VI). A forma deste sal obtida depende da temperatura prevalecente durante o processamento da rocha sedimentar original. O gesso utilizado na construção é geralmente uma mistura de diferentes formas de sal de cal hidratado. 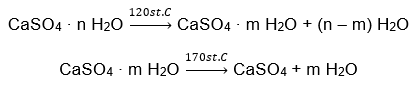
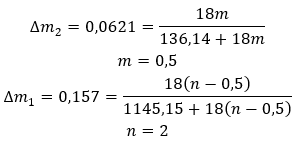 As possibilidades de aplicação do gesso são muito amplas, principalmente na indústria da construção. Os usos mais importantes deste hidrato de sal estão listados abaixo:
As possibilidades de aplicação do gesso são muito amplas, principalmente na indústria da construção. Os usos mais importantes deste hidrato de sal estão listados abaixo:
- Na construção civil, o gesso é utilizado no acabamento de elementos. É um dos componentes de produtos semi-acabados a granel, argamassas, adesivos, acabamentos à base de gesso e componentes de montagem prontos, como por exemplo placas de gesso.
- A medicina usa gesso para proteger membros quebrados. As bandagens de gesso são consideradas amigas da pele. Além disso, o material também é utilizado em laboratórios de tecnologia odontológica.
- A indústria utiliza gesso em oficinas de modelagem e design. Os moldes de gesso são muito adequados para moldar diversos objetos utilitários.
- O gesso é um aditivo para alguns fertilizantes utilizados na agricultura.

Clatratos de metano
Os clatratos de metano pertencem a um grupo de compostos conhecidos como hidratos gasosos. Eles são responsáveis pela maior parte das rápidas mudanças climáticas na história da Terra. Os clatratos de metano também são frequentemente chamados de hidratos de metano ou gelo de metano. Eles formam uma forma sólida de água e metano . Suas moléculas se distinguem por sua estrutura cristalina. Eles são formados sob pressão aumentada. Eles assumem a forma de sólidos brancos e inodoros, que muitas vezes são semelhantes, em termos de aparência externa, ao gelo. Curiosamente, eles se assemelham ao poliestireno ao toque. Os clatratos são agrupamentos químicos únicos . As moléculas de água formam uma estrutura que lembra uma gaiola. O metano é armazenado dentro desta gaiola. É importante ressaltar que as duas substâncias não formam ligações químicas entre si. Normalmente, os clatratos de metano consistem em 46 moléculas de água envolvendo duas gaiolas pequenas e seis de tamanho médio. Moléculas de metano ficam presas dentro delas. Sabe-se também que os clatratos são compostos de 136 moléculas de água com 16 gaiolas pequenas e oito grandes de gás metano em seu interior. Nos últimos anos, quantidades significativas deste recurso foram descobertas no fundo dos oceanos. Está atraindo muito interesse devido ao potencial de extração de quantidades significativas de metano, que pode ser usado, por exemplo, para fins energéticos. Os clatratos de metano queimam com uma chama uniforme, de cor avermelhada. Após a queima, permanece água derretida. O metano extraído desta forma pode ser uma boa alternativa às fontes convencionais de hidrocarbonetos , mas é também uma grande ameaça para o clima. Ainda não há conhecimento suficiente sobre a exploração do metano proveniente de clatratos acumulados no fundo do oceano. A libertação descontrolada de quantidades significativas deste gás pode ser muito perigosa, pois aumenta o efeito de estufa muito mais fortemente do que o dióxido de carbono.
