O termo “elemento” refere-se a átomos cujos núcleos contêm um determinado número de prótons. Além deles, um núcleo atômico também é formado por outra chamada: os nêutrons. Seu número dentro de um único elemento pode variar. Nesse caso, falamos de isótopos, ou seja, variantes de um determinado elemento que possuem diferentes números de nêutrons em seu núcleo. Assim, seus números de massa também são diferentes. No entanto, o número atômico permanece constante, pois o número de elétrons nas eletrônicas permanece inalterado.

Por esse motivo, os isótopos de um mesmo elemento têm a mesma posição na tabela periódica e cada um deles tem o mesmo tamanho. Além disso, suas propriedades químicas e físicas são semelhantes. Porém, há diferenças onde principalmente as propriedades físicas são mais diversificadas, o que geralmente ocorre quando lidamos com dois isótopos com diferenças de massa. Isso se deve ao fato de que é a massa que determina toda uma gama de propriedades, como densidade ou velocidade de difusão de partículas. Em contraste, parâmetros como condutividade elétrica ou cor não dependente da massa. A diversidade de propriedades químicas normalmente vem de velocidades desiguais de reação de vários isótopos.
Nuclídeos vs isótopos
Existe um conceito associado aos isótopos, que é mais genérico. Um nuclídeo é um conjunto inteiro de átomos cuja estrutura nuclear é especificamente determinada pelo número de prótons e nêutrons. Isso significa que dois nuclídeos que diferem no número de nêutrons podem ser isótopos. Na prática, todos os isótopos são nuclídeos, mas nem todo nuclídeo é necessariamente um isótopo. A ideia principal por trás desses dois conceitos abrange propriedades químicas no caso de isótopos e propriedades químicas no caso de nuclídeos. Por exemplo:
- Nuclídeos que são isótopos:
- Nuclídeos que não são isótopos:
Isótopos na natureza
Os elementos químicos existentes no ambiente natural são uma mistura de isótopos com composição percentual constante. Dependendo do núcleo, um elemento pode conter um, vários ou mais isótopos. Alguns deles são estáveis, mas alguns se transformam rapidamente. Tal aparência pode produzir isótopos do mesmo ou de um elemento diferente. Essas transições geralmente acompanham a emissão de radiação. Para usar valores particulares, na Terra existem elementos cujos atômicos são iguais ou menores que 92. Aqueles com números até 83 são considerados compatíveis. Existem até 81 elementos naturalmente existentes que possuem isótopos estáveis. Entre eles estão o silício, com os isótopos 28 Si, 29 Si e 30 Si, o ferro, com os isótopos 54 Fe, 56 Fe, 57 Fe e 58 Fe, ou o alumínio, que possui apenas um isótopo estável: o 27 Al .
isótopos de hidrogênio
Na natureza, podemos encontrar três isótopos de hidrogênio que formam uma mistura de elementos. Na prática, os isótopos 1 H (hidrogênio-1) e 2 H (hidrogênio-2) representam a maioria de, respectivamente, 99,985%e 0,015 %da ocorrência total de hidrogênio. O isótopo 3H (hidrogênio-3) é incontestável e representa apenas alguns vestígios. O hidrogênio-1 é o prótio mais conhecido, o hidrogênio-2 (também chamado deutério) é feito de um próton e um nêutron, enquanto o núcleo do último isótopo (hidrogênio-3, ou seja, trítio) contém um próton e dois nêutrons . Por isso, a diferença de massa entre esses isótopos é significativa: o átomo de deutério é duas vezes mais pesado que o do prótio, enquanto o trítio chega a ser três vezes mais pesado que o prótio. Como sabemos, o hidrogênio em qualquer forma isotópica existe como uma molécula diatômica. Acontece que também pode formar uma lista contendo diferentes isótopos, ou seja, HD (prótio-deutério), HT (prótio-trítio) e DT (deutério-trítio). O deutério é um isótopo não radioativo e de alta estabilidade. Às vezes é referido como hidrogênio pesado. Se substituirmos o hidrogênio-1 por deutério em uma molécula de água (D 2 O), a molécula mudará suas propriedades: o ponto de fusão aumentará em cerca de 1,5 o C e o ponto de congelamento cairá em até 3,81 o C Sua densidade também aumentará em relação ao H 2 O em cerca de 0,1%. Em contraste, o trítio é um isótopo altamente impressionante que também é radioativo. Seu núcleo é um local de decomposições radioativas espontâneas que afetam átomos de hélio. Se compararmos as propriedades físicas-químicas dos isótopos, encontraremos diferenças essenciais, que são desenvolvidas na Tabela 1. Tabela 1. Comparação dos requisitos físico-químicos básicos dos isótopos de hidroginástica.
| Isótopo | Símbolo | Densidade [g /l] | Ponto de fusão [K] | Ponto de ebulição [K] |
| Protium | H | 0,08233 | 13.83 | 20.27 |
| deutério | D | 0,1645 | 18.73 | 23.67 |
| trítio | T | 0,2464 | 20.62 | 25.04 |
isótopos de carbono
O carbono possui três isótopos conhecidos: 12 C, 13 C e 14 C, cada um com as mesmas propriedades químicas. O mais comum é o carbono-12, que representa 98,89%até de todos os átomos. O isótopo 13 C existente na Terra representa cerca de 1,11%, enquanto o átomo de 14 C ocorre em um por cerca de 10 12 . Este último está predisposto a uma constituição orgânica, que provoca a emissão de radiação beta. Então o isótopo se transforma em um átomo de mosca. Um isótopo estável é o carbono-13. Devido ao seu spin diferente de zero, pode ser aplicado em ressonância magnética nuclear de 13 NMR.
Aplicação de isótopos
Nos detectores de fumaça, usamos isótopos instáveis, 241 Am ou 238 Pu, que se caracterizam por uma crise lenta combinada com a emissão de radiação. À medida que a fumaça aparece, a radiação é bloqueada e não chega mais ao detector, acionando o alarme. A radiação de emissão de alguns elementos é capaz de destruir microorganismos e, portanto, isótopos, incluindo 60 Co, podem ser usados para conservar alimentos. No diagnóstico médico, certos núcleos são usados para detectar alterações nos órgãos testados, por exemplo, nos rins ou no coração. Tal isótopo se combina com uma substância biologicamente inativa com um caminho conhecido no corpo e introduz no sistema de circulação sanguínea. Isso permite rastrear o caminho da radiação e observar como ela se acumula nos tecidos e órgãos. No tratamento de tumores, aplicamos também a radioterapia baseada na emissão de radiação por isótopos instáveis, como 226 Ra e 60 Co. O objetivo dessa terapia é destruir as células tumorais. Um dos isótopos de carbono, 14 C, é aplicado para avaliar a idade de materiais de origem orgânica. Esse núcleo se decompõe lentamente e, se o organismo morre (que é quando a assimilação do carbono cessa), sua concentração de carbono-14 diminui proporcionalmente com o passar dos anos. Alguns isótopos, por exemplo 239 Pu e 235 U, são usados em usinas químicas. Durante a transformação desses núcleos instáveis, é produzida energia que por sua vez pode ser transformada em eletricidade.
Massa atômica e isótopos
A massa atômica dos elementos apresentada na tabela periódica é, na verdade, a massa média. Ao calculá-lo, levamos em consideração o número (n) e a composição percentual (x n ) de cada isótopo do elemento em questão, conforme a seguinte fórmula: 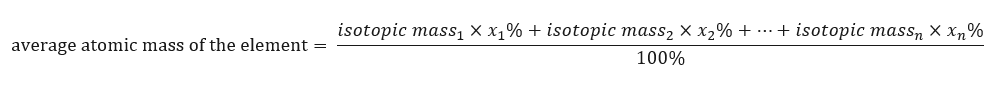 Por exemplo, ao calcular a massa atômica média do hidrogênio, obteremos a seguinte aprovação:
Por exemplo, ao calcular a massa atômica média do hidrogênio, obteremos a seguinte aprovação: 
