A eletronegatividade é uma quantidade que reflete a tendência de um determinado átomo dentro de uma molécula de atrair elétrons para si. Na prática, é a capacidade de um átomo ou grupos funcionais atrair densidade eletrônica. A escala associada a esta quantidade mais utilizada é a introduzida por Linus Pauling, que permite calcular facilmente a natureza aproximada da ligação.

Características de eletronegatividade
Moléculas homonucleares, por exemplo H 2 e O 2 , têm coeficientes iguais c A e c B em seus orbitais moleculares, que podem ser registrados como funções de onda: Ψ +AB = c A Ψ A + c B Ψ B Ψ −AB = c A Ψ A − c B Ψ B Neste caso, o orbital é caracterizado por sua forma ser simétrica em relação ao centro da molécula, e sua carga elétrica estar igualmente distribuída simetricamente dentro dele. Porém, outro exemplo são as moléculas heteronucleares, nas quais é virtualmente impossível manter coeficientes iguais, bem como simetria total em relação ao centro da molécula. Quando o nível de energia do orbital atômico Ψ B é inferior ao nível de energia do orbital atômico Ψ A , a relação ocorre, e o máximo da densidade de probabilidade do elétron é deslocado em direção ao átomo B. Na prática, isso resulta em um deslocamento do elétron par na ligação química, ou seja, polarização em direção ao átomo B. Por exemplo, na molécula de hidreto de lítio LiH esse deslocamento é em direção ao átomo de hidrogênio, enquanto na molécula de fluoreto de hidrogênio HF é em direção ao átomo de flúor. Isso significa que o átomo de hidrogênio tem um nível de energia inferior ao do lítio, mas um nível de energia superior ao do flúor (leia sobre halogênios ). Nessas condições, um dos átomos de ambas as moléculas assume uma carga negativa denotada como -δ e o outro é positivo +δ. A fórmula geral de tal molécula é A +δ B -δ .
Cargas de átomos
A referida carga δ pode assumir valores diferentes dependendo dos elementos ligados pela ligação química . Seu valor 0 significa que a carga do par de elétrons está distribuída simetricamente e o par está localizado completamente nas proximidades do átomo com menor nível de energia, resultando na transferência de ambos os elétrons para aquele átomo. Isso cria uma ligação iônica entre os elementos. Na grande maioria das ligações químicas, entretanto, existem cargas fracionárias, resultando em um estado entre a ligação covalente e a iônica.
Momento dipolar
Um dipolo é uma molécula na qual dois pólos – positivo e negativo – podem ser distinguidos. O momento dipolar, denotado por μ, é uma medida da magnitude da mudança de carga elétrica nele. É definido como o produto do valor absoluto da carga elétrica (δ) contida em um dos pólos e a distância desses pólos (l): μ = δ · l Uma carga positiva (δ+) e uma carga negativa ( δ-) é chamada de carga parcial e sua localização é atribuída a um determinado átomo, mas na realidade é apenas a maior ou menor probabilidade de um elétron estar presente ao redor de seus núcleos. Tal fenômeno às vezes é confundido com os processos de oxidação e redução , mas diferentemente das mudanças que neles ocorrem, tais cargas sendo assumidas pelos átomos não faz com que eles passem para outro estado de oxidação, portanto não há troca de elétrons entre eles. eles. A unidade SI para expressar o momento dipolar é o medidor de Coulomb (C·m). Porém, nos cálculos, a unidade escrita no sistema CGS, o debye (D), é mais comumente usada. Um debye corresponde a um valor de 3,33564·10 -30 C·m. O maior momento dipolar teoricamente possível caracteriza moléculas com uma ligação puramente iônica. Considerando que o menor ocorre em moléculas cuja ligação é puramente covalente – o momento dipolar é zero neste caso. No entanto, a maioria são casos intermediários com características de partículas variadas.
Momento dipolo de halogênio
Várias relações entre eletronegatividade e momento dipolar podem ser facilmente observadas em compostos químicos específicos. Tabela 1 Momentos dipolares de haletos de hidrogênio
| Composto | Momento dipolar determinado experimentalmente [ μ, D] | Comprimento do vínculo [pm] | Produto da carga elementar e comprimento do dipolo [e ·l, D] | Compartilhamento de caráter iônico [ %] | Diferença na eletronegatividade de halogênio e hidrogênio |
| AF | 1,98 | 92 | 4,42 | 45 | 1,9 |
| HCl | 1.08 | 128 | 6.15 | 18 | 0,9 |
| HBr | 0,79 | 143 | 6,87 | 12 | 0,7 |
| OI | 0,38 | 162 | 7,78 | 5 | 0,4 |
A razão μ/(e·l’), ou seja, o momento de dipolo real para o momento de dipolo que corresponde a uma ligação iônica, pode fornecer uma medida dos desvios da ligação totalmente covalente. O produto desta relação na forma de (μ/(e·l’))·100%representa a porcentagem do caráter iônico na ligação. Este é apenas um valor aproximado, pois o momento dipolar depende não apenas da polaridade da ligação, mas também do comportamento dos pares de elétrons livres. Acontece que a nuvem de elétrons pode ser deslocada para fora da molécula, e a consequência é que a equação para determinar seu momento dipolar possui um componente adicional. No caso da molécula de amônia, a nuvem é direcionada em linha com o momento dipolar da ligação, resultando em um aumento no momento dipolar resultante. Em contraste, o oposto é verdadeiro para a molécula de monóxido de carbono, onde a nuvem é direcionada na direção oposta e consequentemente reduz o momento dipolar resultante. 
Eletro-negatividade
É uma quantidade empírica adimensional que reflete a tendência de um determinado átomo dentro de uma molécula de atrair elétrons para si. Na prática, é a capacidade de um átomo ou grupos funcionais atrair densidade eletrônica. A escala associada a esta quantidade mais utilizada é a introduzida por Linus Pauling, que permite calcular facilmente a natureza aproximada da ligação. O cientista usou o seguinte método para calcular a eletronegatividade dos elementos individuais: Assumimos que D AA e D BB são as energias de ligação das moléculas de dois átomos (A 2 , B 2 ). Designamos a energia de ligação que ocorre na molécula como DAB . Empiricamente, foi demonstrado que se tal ligação contém pouco ou nenhum caráter iônico, a diferença entre os valores de DA AB e a média geométrica dos valores de energia de DAA e D BB é igual ou próxima de zero. Quando a ligação AB apresenta desvios claros do caráter covalente, essa diferença assume valores positivos, que aumentam à medida que aumenta a proporção do caráter iônico. A diferença entre a eletronegatividade (x) dos dois átomos envolvidos na ligação é expressa pela fórmula: ![]() Portanto, se Pauling assumiu uma eletronegatividade do flúor de 4,0 em seus cálculos, é possível calcular as eletronegatividades subsequentes dos elementos. Se conhecermos o valor de x A dos átomos do elemento A e o valor do coeficiente Δ’, então podemos calcular o valor de x B usando a equação acima. A escala de Pauling é construída de tal forma que seus valores coincidem aproximadamente com os valores do momento dipolar da ligação formada pelos átomos considerados, como podemos ver no exemplo da Tabela 1, que contém os valores determinados para os haletos de hidrogênio. . Além da escala descrita acima, existem várias outras descritas na literatura científica, incluindo a eletronegatividade descrita por:
Portanto, se Pauling assumiu uma eletronegatividade do flúor de 4,0 em seus cálculos, é possível calcular as eletronegatividades subsequentes dos elementos. Se conhecermos o valor de x A dos átomos do elemento A e o valor do coeficiente Δ’, então podemos calcular o valor de x B usando a equação acima. A escala de Pauling é construída de tal forma que seus valores coincidem aproximadamente com os valores do momento dipolar da ligação formada pelos átomos considerados, como podemos ver no exemplo da Tabela 1, que contém os valores determinados para os haletos de hidrogênio. . Além da escala descrita acima, existem várias outras descritas na literatura científica, incluindo a eletronegatividade descrita por:
- Mulliken, cujo trabalho assumiu que a eletronegatividade de um elemento é diretamente proporcional à soma de sua afinidade eletrônica e energia de ionização. Afinidade eletrônica, que é a quantidade de energia liberada devido à ligação de um elétron a um átomo neutro, e a energia de ionização igual à quantidade de energia necessária para separar um elétron de um átomo neutro. As eletronegatividades mais altas são, portanto, características de átomos que exibem alta afinidade eletrônica e alta energia de ionização.
- Allred e Rochow, que assumiram a proporcionalidade da eletronegatividade à medida da força com que o núcleo atômico (Z) atua sobre os elétrons de valência, registraram como
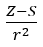 (r – raio atômico, S – constante de blindagem). De acordo com sua teoria, a eletronegatividade (x) dos elementos pode ser calculada pela fórmula:
(r – raio atômico, S – constante de blindagem). De acordo com sua teoria, a eletronegatividade (x) dos elementos pode ser calculada pela fórmula:
![]() Em cada escala, a eletronegatividade do hidrogênio está próxima do valor de 2,2, com outros valores variando ligeiramente. Exemplos de eletronegatividades de átomos elementares calculadas de acordo com as escalas de Pauling, Mulliken e Allred e Rochow são mostrados na Tabela 2 abaixo. Tabela 2 Eletronegatividades de elementos exemplares nas escalas Pauling (P), Mulliken (M) e Allred e Rochow (AR)
Em cada escala, a eletronegatividade do hidrogênio está próxima do valor de 2,2, com outros valores variando ligeiramente. Exemplos de eletronegatividades de átomos elementares calculadas de acordo com as escalas de Pauling, Mulliken e Allred e Rochow são mostrados na Tabela 2 abaixo. Tabela 2 Eletronegatividades de elementos exemplares nas escalas Pauling (P), Mulliken (M) e Allred e Rochow (AR)
| Átomo | P | M | RA |
| F | 3,98 | 3,90 | 4.10 |
| Ó | 3,44 | 3.04 | 3,50 |
| N | 3.04 | 2.28 | 3.07 |
| Cl | 3.16 | 2,95 | 2,83 |
| C | 2,55 | 1,75 | 2,50 |
| H | 2.20 | 2.21 | 2.20 |
| Si | 1,90 | 2,25 | 1,74 |
| F | 0,82 | 0,77 | 0,91 |
| Rb | 0,82 | 0,50 | 0,89 |
| Cs | 0,79 | – | 0,86 |
| Padre | 0,70 | – | 0,86 |
Apesar das discrepâncias nos cálculos com os três métodos, o flúor apresenta a maior eletronegatividade em cada escala, seguido pelo oxigênio, nitrogênio e cloro . Os menores valores foram determinados para frâncio, césio, rubídio e potássio. Elementos que normalmente são não-metais têm eletronegatividades acima do valor de 2, metais típicos têm eletronegatividades abaixo de 2. O valor padrão é a eletronegatividade do hidrogênio acima mencionada de aproximadamente 2,2. 
Eletronegatividade na tabela periódica
Como muitas outras propriedades, a eletronegatividade também se reflete na disposição dos elementos químicos na tabela periódica . No grupo, a eletronegatividade diminui com o aumento do número de conchas e do caráter metálico, aumentando na direção do frâncio para o hidrogênio. Com o tempo, a eletronegatividade aumenta com o aumento dos elétrons de valência presentes e a diminuição do caráter não metálico, passando de metais para gases nobres .
Eletronegatividade e tipo de ligação – resumo
Conhecendo os valores individuais da eletronegatividade dos elementos que formam a ligação química, podemos deduzir a sua natureza. Se a diferença estiver entre 0,0 e 0,4, a ligação é covalente. Quando a diferença está entre 0,4 e 1,7, a ligação é covalente polarizada. Uma diferença acima de 1,7 na eletronegatividade dos elementos sugere ligação iônica.
