Este é um grupo de compostos inorgânicos formados pela combinação de vários elementos com oxigênio. Sua fórmula geral é X n O m , onde "X" é qualquer elemento, "O" é oxigênio, sempre no segundo estado de oxidação, e as letras "n,m" no índice inferior são coeficientes. Exemplos de óxidos: água H 2 O, óxido de potássio K 2 O, óxido de alumínio Al 2 O 3 , óxido de cálcio CaO e monóxido de carbono (II) CO.

Classificação de óxidos
Os óxidos podem ser classificados em várias categorias. A classificação mais geral é a distinção entre óxidos metálicos, por exemplo, óxido de lítio, óxido de magnésio, óxido de alumínio, óxido de ferro e óxidos não metálicos, incluindo óxido de carbono, óxido de nitrogênio, óxido de enxofre e óxido de cloro . Outro critério é a classificação de acordo com seu estado físico. Quase todos os óxidos metálicos e alguns não metais (SiO 2 , P 4 O 10 ) são sólidos. Água, óxido de enxofre (VI) e óxido de manganês (VII) são líquidos. Óxidos não metálicos como CO, CO 2 , SO 2 , NO i NO 2 são gases. Os óxidos também podem ser classificados de acordo com o tipo de ligações que ocorrem neles. O óxido de magnésio MgO, o óxido de cálcio CaO ou o óxido de sódio Na 2 O contêm íons O 2- e ligações iônicas, daí seu nome – óxidos iônicos. Outro grupo são os óxidos covalentes, por exemplo, monóxido de carbono (II) CO, óxido nítrico (II) NO ou óxido de enxofre (IV) SO 2 , em que a ligação entre o átomo de oxigênio e o elemento tem a forma de uma ligação covalente polar.
O caráter químico dos óxidos
Para os químicos, a classificação mais interessante é baseada na natureza química dos óxidos. Existem quatro categorias principais de óxidos – ácidos, básicos, neutros e anfóteros.
- Óxidos ácidos , às vezes também chamados de anidridos ácidos, distinguem-se pelo fato de reagirem com álcalis com a formação de sal. Uma parte significativa dos óxidos ácidos forma soluções apropriadas de oxiácidos após dissolução em água. Isso se aplica, por exemplo, ao óxido de enxofre (IV), que quando dissolvido em água produz ácido sulfúrico (IV) e ao óxido de cromo (VI) que se dissolve em ácido crômico (VI):
SO 2 + H 2 O → H 2 SO 3 CrO 3 + H 2 O → H 2 CrO 4 Existe um pequeno grupo de óxidos ácidos que são insolúveis em água. No entanto, eles são solúveis em soluções de álcalis fortes , por exemplo, silício ( IV) óxido SiO 2 , óxido de molibdênio (VI) MoO 3 e óxido de tungstênio (VI) WO 3 . Suas reações com álcalis confirmam seu caráter ácido: SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O MoO 3 + 2KOH → K 2 MoO 4 + H 2 O WO 3 + 2NaOH → Na 2 WO 4 + H 2 O Como um Regra geral, os óxidos ácidos são óxidos não metálicos e óxidos metálicos nos seus estados de oxidação mais elevados possíveis. Se um determinado elemento forma vários óxidos em diferentes estados de oxidação, como por exemplo o cromo, as propriedades ácidas de seus óxidos aumentam com o aumento de seu estado de oxidação:
- óxido de cromo (II) CrO é alcalino,
- o óxido de cromo (III) Cr 2 O 3 tem propriedades anfotéricas,
- óxido de cromo (VI) CrO 3 é ácido.

- Os óxidos alcalinos são aqueles compostos de oxigênio com metais que reagem com ácidos para dar produtos na forma dos sais correspondentes. Alguns deles, ou seja, óxidos de elementos do primeiro e segundo grupo da tabela periódica, excluindo o berílio, também são caracterizados por uma reação com a água resultando na formação de hidróxidos alcalinos. Ocorre, por exemplo, durante a reação de óxido de sódio, óxido de lítio e óxido de bário com água:
Na 2 O + H 2 O → 2NaOH Li 2 O + H 2 O → 2LiOH BaO + H 2 O → Ba(OH) 2 Existem também óxidos alcalinos que não se dissolvem em água, mas apenas em soluções ácidas. Estes incluem, por exemplo, óxido de manganês (II) e óxido de ferro (II): MnO + H 2 SO 4 → MnSO 4 + H 2 O FeO + 2HCl → FeCl 2 + H 2 O
- Os óxidos neutros são o grupo menos reativo de óxidos. Eles não reagem com ácidos ou álcalis. Eles também são insolúveis em água. Exemplos deste grupo de óxidos são o monóxido de carbono (II) CO e o óxido nítrico (II) NO.
- Os óxidos anfóteros são o completo oposto dos óxidos neutros e são ácidos e alcalinos ao mesmo tempo. Isso significa que eles reagem tanto com álcalis fortes quanto com ácidos. Os produtos dessas reações são sempre sais, e o elemento inicialmente combinado com o oxigênio é transformado em um cátion ou ânion apropriado do resíduo ácido. A única semelhança com os óxidos neutros é sua baixa solubilidade em água. Exemplos de óxidos anfóteros são: óxido de berílio BeO, óxido de alumínio Al 2 O 3 , óxido de cromo (III), óxido de estanho (II) SnO, óxido de chumbo (II) PbO e óxido de zinco ZnO. Ao reagir com soluções aquosas de álcalis fortes, por exemplo, com uma solução aquosa de hidróxido de sódio , eles formam sais complexos . Em seus resíduos ácidos, átomos ou íons do metal, que é derivado do óxido, estão presentes em complexos com um número apropriado de grupos hidroxila. Seu número depende do número de coordenação do elemento dado. Por exemplo, átomos derivados de óxidos de MO (M – metal), como o óxido de berílio BeO, têm número de coordenação 4. Átomos derivados de óxidos do tipo M 2 O 3 , por exemplo Al 2 O 3 , podem ter dois números de coordenação diferentes, e dependendo das condições da reação é 4 ou 6. Exemplos de reações de óxidos anfóteros:
BeO + 2HCl → BeCl 2 + H 2 O BeO + 2NaOH + H 2 O → Na 2 [Be (OH) 4] tetrahidroxizincato de sódio Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O Al 2 O 3 + 2KOH + 3H 2 O → 2K[Al (OH) 4] tetrahidroxialuminato de potássio Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 [Al (OH) 6] hexahidroxialuminato de sódio Alguns óxidos , como o óxido de zinco e o óxido de manganês (IV), possuem propriedades anfotéricas bastante específicas. Este último, nem em condições normais nem padrão, não reage com álcalis. Ambos, por outro lado, reagem com eles fundindo-se com álcalis sólidos, por exemplo: 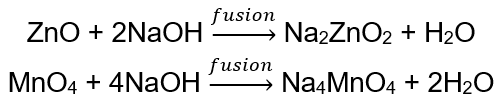

Obtenção de óxidos
- Síntese direta de elementos: a) síntese de átomos de enxofre e átomos de oxigênio com formação de óxido de enxofre (IV) S + O → SO 2 b) síntese de átomos de magnésio e átomos de oxigênio com formação de óxido de magnésio 2Mg + O 2 → 2MgO c) síntese de átomos de carbono e átomos de oxigênio com formação de monóxido de carbono (IV) C + O 2 → CO 2
- Decomposição térmica de sais , hidróxidos e óxidos: a) decomposição de carbonato de cálcio em óxido de cálcio e monóxido de carbono (IV) CaCO 3 → CaO + CO 2 b) decomposição de hidróxido de cobre (II) em óxido de cobre (II) e água Cu( OH) 2 → CuO + H 2 O c) decomposição do óxido de manganês (IV) em óxido de manganês (III) e oxigênio 4MnO 2 → 2Mn 2 O 3 + O 2
- Oxidação de óxidos em estados de oxidação mais baixos, com aumento de sua valência: a) oxidação de óxido de enxofre (IV) a óxido de enxofre (VI) 2SO 2 + O 2 → 2SO 3 b) oxidação de óxido nítrico (II) a nítrico ( IV) óxido 2NO + O 2 → 2NO 2 c) oxidação de carbono (II) monóxido a carbono (IV) monóxido (IV) 2CO + O 2 → 2CO 2
- Redução de óxidos em estados de oxidação mais elevados, com diminuição de sua valência: a) redução de monóxido de carbono (IV) a monóxido de carbono (II) monóxido (II) CO 2 + C → 2CO b) redução de óxido de estanho (II) a estanho (I) óxido 2SnO + O 2 → 2SnO 2
- Combustão de compostos orgânicos: a) combustão de metano em oxigênio com formação de monóxido de carbono (IV) e água CH 4 + 2O 2 → CO 2 + 2H 2 O b) combustão de amônia em oxigênio para obtenção de óxido nítrico (II) e água 4NH 3 + 5O 2 → 4NO + 6H 2 O
- Reação de oxiácidos instáveis: a) decomposição do ácido carbônico (IV) em monóxido de carbono (IV) e água: H 2 CO 3 → CO 2 + H 2 O b) decomposição do ácido sulfúrico (IV) em óxido de enxofre (IV) e água: H 2 SO 3 → SO 2 + H 2 O
