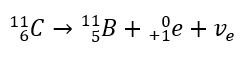Para realizar o teste, foi utilizado um filme fotográfico, que escureceu sob a influência desses raios. O experimento mostrou que a radiação solar não é necessária para o material de teste escurecer o filme. No entanto, isso contradizia a hipótese inicial, então mais pesquisas tiveram que ser realizadas. Desta vez, a tarefa era confirmar ou negar os raios X como o fator causador da alteração no filme. Foi usado o fato de que os raios X não carregam nenhuma carga, portanto não são dobrados pelo campo magnético. Becquerel colocou um material contendo urânio e o filme fotográfico em uma câmara de vácuo localizada em um campo magnético. Como resultado do experimento, descobriu-se que os raios emitidos pela amostra testada se dobram no campo magnético, o que significava que não eram iguais aos raios-X. No decorrer de sua pesquisa, o cientista mostrou que existem três tipos de radiação que os materiais podem emitir – neutra, carregada positivamente e carregada negativamente. Com base nessas suposições, os pesquisadores subsequentes apresentaram suas teses e conduziram novos experimentos. Maria Skłodowska Curie e Pierre Curie descobriram os próximos elementos radioativos: polônio e rádio. Ernest Rutherford, Prêmio Nobel de Química , também dedicou parte de sua carreira à radioatividade e nomeou os tipos de radiação descobertos por Becquerel com as letras gregas do alfabeto: alfa, beta e gama.
De onde vem a radioatividade?
A pesquisa mostrou que a radioatividade é uma característica de alguns elementos. Isso indica sua estreita relação com seu nível atômico e, mais especificamente, com o núcleo atômico. Cada um dos três tipos de radiação é um quantum de energia que um núcleo instável pode emitir. Isso significa que a radiação é, na verdade, o resultado de seu decaimento. A ocorrência de tais núcleos instáveis é, na prática, causada por sua proporção de prótons para nêutrons. Devido aos diferentes tipos de instabilidade, também existem diferentes tipos de radiação. A chave para entender a radioatividade são os isótopos e suas diferenças no nível atômico. Por exemplo, o isótopo de carbono mais comum 12 C não é radioativo, enquanto o 14 C é radioativo. Seu número atômico e, portanto, o número de prótons, é o mesmo. A diferença também não pode ser devido ao número de elétrons, porque o átomo seria então um íon carregado positivamente ou negativamente. A única possibilidade, no caso dos isótopos, são diferenças no número de nêutrons no núcleo. O 14 C tem dois nêutrons a mais que o 12 C, portanto também é mais pesado. A existência de isótopos para todos os elementos significa que o número de núcleos radioativos também é grande. Esses isótopos instáveis e radioativos são chamados de radioisótopos, mas sua prevalência não é tão alta quanto a visível na tabela periódica dos elementos .
Por que o núcleo pode ser instável?
Os prótons e nêutrons no núcleo estão sujeitos a grandes forças nucleares que os mantêm unidos, superando a repulsão eletrostática entre os prótons. Ao contrário dos prótons, os nêutrons têm um efeito positivo no fortalecimento da força nuclear. Foi demonstrado que a proporção do número de nêutrons para prótons deve ser de cerca de 1,5:1. Para átomos mais leves abaixo de 20u, a proporção estável é de 1:1. Caso contrário, os núcleos tendem a se desintegrar. Todos os isótopos de elementos com peso atômico acima de 208 são instáveis.
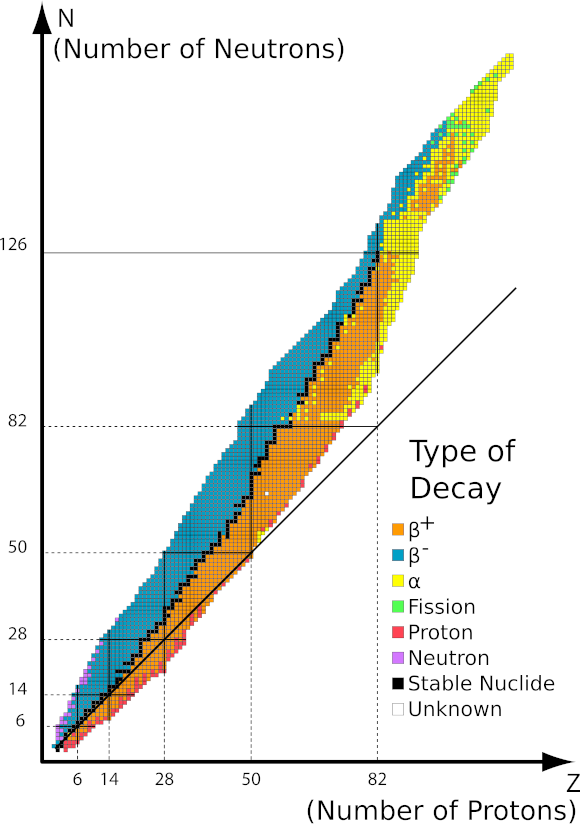
Figura 1 Gráfico da área de estabilidade em função do número de nucleons no núcleo. Fonte: http://ch302.cm.utexas.edu/nuclear/radioactivity/selector.php?name=band-stability
O gráfico apresentado acima mostra a dependência da estabilidade do núcleo no número de núcleos individuais. A linha preta corresponde a uma proporção de 1:1 de nêutrons para prótons. Os isótopos estáveis são marcados com quadrados pretos e os isótopos instáveis com as cores correspondentes de acordo com a legenda. A estabilidade dos isótopos radioativos é maior quanto mais próximos eles estiverem de uma proporção estável. De acordo com o gráfico, podemos distinguir três tipos de decaimentos:
- Decaimento alfa, especialmente em núcleos maciços, emitindo dois prótons e dois nêutrons,
- Decaimento beta menos, quando o núcleo tem poucos prótons, resultando na emissão de elétrons,
- Beta mais decaimento, se o núcleo atômico tiver excesso de prótons, com emissão de pósitrons.
Esses tipos de decaimentos envolvem uma mudança no número de prótons no núcleo e, portanto, também uma mudança do elemento químico de um para outro.
Radiação alfa (α)
Experimentalmente, em 1909, E. Rutherford e T. Royds mostraram que as partículas alfa são idênticas aos íons de hélio. Depois de passar a radiação alfa pelas paredes finas de uma câmara de vácuo, a imagem das linhas espectrais no espectrômetro óptico obtido na câmara de gás claramente confirmou isso. Por exemplo, o núcleo de 240 Pu sofre radiação alfa, conforme a reação: 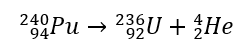 A radiação alfa é caracterizada por partículas carregadas positivamente com um alcance de vários centímetros no ar e permeabilidade muito baixa. Um pedaço de papel irá detê-los.
A radiação alfa é caracterizada por partículas carregadas positivamente com um alcance de vários centímetros no ar e permeabilidade muito baixa. Um pedaço de papel irá detê-los.
Radiação beta (β)
No caso da radiação beta-menos, são emitidos elétrons vindos do núcleo. Como os núcleos não se caracterizam pela presença de elétrons, eles se formam apenas durante o decaimento e, além deles, também é emitida uma segunda partícula – o antineutrino do elétron. Devido ao aumento do número de prótons na molécula, o elemento beta em decaimento se transforma em outro elemento com maior número atômico. Um exemplo de um curso de decaimento é consistente com este mecanismo: 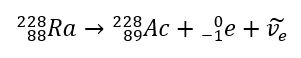 Esta radiação é caracterizada por partículas carregadas negativamente com um alcance de várias dezenas de centímetros no ar e maior permeabilidade em comparação com a radiação alfa. É retido por uma folha de alumínio com uma espessura de cerca de 3 a 4 mm. O decaimento beta-plus ocorre de forma semelhante, mas emite partículas de pósitrons e neutrinos de elétrons. O número de prótons no núcleo diminui e o elemento que o sofre é transformado em outro de número atômico menor, como no exemplo:
Esta radiação é caracterizada por partículas carregadas negativamente com um alcance de várias dezenas de centímetros no ar e maior permeabilidade em comparação com a radiação alfa. É retido por uma folha de alumínio com uma espessura de cerca de 3 a 4 mm. O decaimento beta-plus ocorre de forma semelhante, mas emite partículas de pósitrons e neutrinos de elétrons. O número de prótons no núcleo diminui e o elemento que o sofre é transformado em outro de número atômico menor, como no exemplo: 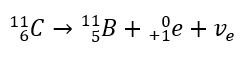
Radiação gama (γ)
É o único tipo de radiação que não transforma um elemento em outro, pois não emite nenhuma partícula, apenas a própria radiação gama. É um dos tipos de ondas eletromagnéticas, semelhante à luz infravermelha ou ultravioleta, mas a onda de radiação gama é a mais curta. O processo de decaimento provoca a transição do núcleo excitado do átomo para um estado de menor energia, resultando na emissão de fótons com energia equivalente ao núcleo do átomo em estados individuais. O diagrama do curso do decaimento gama pode ser escrito como: 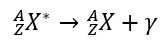 A característica da radiação gama é sua identificação com uma onda eletromagnética de alta frequência e natureza luminosa. O alcance no ar é teoricamente ilimitado, enquanto a permeabilidade é a maior de todos os tipos de radioatividade. É interrompido apenas por uma parede espessa ou uma camada de chumbo de quinze centímetros.
A característica da radiação gama é sua identificação com uma onda eletromagnética de alta frequência e natureza luminosa. O alcance no ar é teoricamente ilimitado, enquanto a permeabilidade é a maior de todos os tipos de radioatividade. É interrompido apenas por uma parede espessa ou uma camada de chumbo de quinze centímetros.


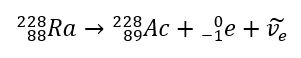 Esta radiação é caracterizada por partículas carregadas negativamente com um alcance de várias dezenas de centímetros no ar e maior permeabilidade em comparação com a radiação alfa. É retido por uma folha de alumínio com uma espessura de cerca de 3 a 4 mm. O decaimento beta-plus ocorre de forma semelhante, mas emite partículas de pósitrons e neutrinos de elétrons. O número de prótons no núcleo diminui e o elemento que o sofre é transformado em outro de número atômico menor, como no exemplo:
Esta radiação é caracterizada por partículas carregadas negativamente com um alcance de várias dezenas de centímetros no ar e maior permeabilidade em comparação com a radiação alfa. É retido por uma folha de alumínio com uma espessura de cerca de 3 a 4 mm. O decaimento beta-plus ocorre de forma semelhante, mas emite partículas de pósitrons e neutrinos de elétrons. O número de prótons no núcleo diminui e o elemento que o sofre é transformado em outro de número atômico menor, como no exemplo: