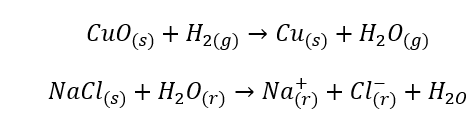As deliberações sobre vários fenômenos e processos devem ser multicamadas. Devemos levar em conta as propriedades microscópicas e macroscópicas. Como os nomes sugerem, essa divisão é feita separando as ordens de grandeza dos itens analisados. O domínio macroscópico, intimamente ligado à termodinâmica das reações químicas, permite observar e medir propriedades físicas e químicas como densidade, temperatura ou solubilidade. Pela análise microscópica, podemos observar os movimentos e as interações das moléculas. Podemos descrever moléculas em termos de sua velocidade e energia cinética. Se estivermos interessados numa mistura, podemos ter em conta a sua homogeneidade e, consequentemente, o tipo de sistema em que existe.

Classificação de sistemas físico-químicos
Ao analisar a homogeneidade dos sistemas materiais, a escala macroscópica os classifica em dois grupos principais: sistemas homogêneos e sistemas heterogêneos. Essa categorização se dá por suas características físicas: estado físico, solubilidade e ponto de fusão, que podem diferir ou não. Todo sistema inclui todas as substâncias que participam de uma determinada reação ou processo. A porção do sistema que claramente se destaca por manter as mesmas propriedades é chamada de fase. Existem três tipos diferentes de fases: sólida, líquida e gasosa. A superfície localizada entre eles e o restante do sistema é chamada de interface. Dependendo da entalpia livre (ΔG) ou entropia (ΔS), se ΔS>0 ou ΔG<0, a transformação de uma fase em outra pode ocorrer automaticamente.
Diagrama de equilíbrio de fase
Uma representação gráfica da existência de diferentes fases é chamada de diagrama de equilíbrio de fases. Inclui a existência de fases específicas (se certas faixas de temperatura e pressão forem atingidas) e suas conversões mútuas. Um diagrama esquemático de equilíbrio de fase para um sistema de um componente ilustra a existência de três fases principais, dependendo das condições do processo. As linhas que ele mostra indicam os estados de equilíbrio entre duas fases respectivas, isto é, entre sólido e gás, entre sólido e líquido e entre gás e líquido. Assim, se conhecermos um dos parâmetros críticos, podemos determinar as condições que causarão fusão, congelamento, evaporação, condensação, sublimação ou ressublimação do ingrediente em questão. Além disso, o diagrama inclui um ponto triplo onde todas as linhas de fase se conectam, o que indica que todas as três fases podem coexistir em condições especificadas. O diagrama também inclui dois pontos importantes: pressão crítica e temperatura crítica. A pressão crítica é indicada pelo ponto que representa a pressão máxima na qual podemos converter um líquido em gás, ou a pressão máxima possível de vapor saturado acima do líquido. O conceito de temperatura crítica define a temperatura mais alta na qual um gás pode condensar à medida que a pressão aumenta. Portanto, o ponto crítico existente em condições críticas de temperatura e pressão crítica define um estado no qual as fases líquida e gasosa são impossíveis de diferenciar.
regra da fase de Gibbs
É uma relação específica que pode ser aplicada a qualquer sistema existente em equilíbrio termodinâmico. A equação que representa essa regra contém o número de fases (f) presentes no sistema com o número de constituintes independentes (n) e o número de graus de liberdade (s). O número s corresponde à quantidade de variáveis intensivas ajustáveis que, se alteradas, não irão perturbar o número de fases no equilíbrio do sistema isolado. Variáveis intensivas são quaisquer valores físicos que não dependem de forma alguma do sistema (por exemplo, tamanhos geométricos ou volume) ou do número de suas moléculas, seu peso, calor específico, etc. A equação é a seguinte: Os componentes independentes do sistema , designados por n, representam praticamente o menor número de componentes do sistema necessários para construir cada uma de suas fases em qualquer quantidade. Se analisarmos um sistema cujos componentes podem reagir entre si, calculamos o valor n subtraindo o número de equações de reação independentes do número total de componentes que formam o sistema. Assim, se assumirmos a seguinte notação: ![]() o número de equações independentes é 1 – examinamos uma reação particular que ocorre no sistema. Uma equação independente é qualquer sistema de equações químicas em que é impossível obter qualquer uma delas combinando as outras. Considerando que o número de componentes para tal sistema é 3: eles são CaCO 3 , CaO e CO 2 . Esta informação também nos permite calcular o número de componentes independentes: n = o número de componentes – o número de equações independentes, e assim: n = 3 – 1 = 2 Podemos usar o mesmo exemplo para calcular o número de graus de liberdade usando a equação para a regra de fase de Gibbs: s = n – f + 2 = 2 – 3 + 2 = 1 Este valor indica que para manter uma quantidade estável de fases no equilíbrio do sistema, podemos operar apenas uma variável intensiva.
o número de equações independentes é 1 – examinamos uma reação particular que ocorre no sistema. Uma equação independente é qualquer sistema de equações químicas em que é impossível obter qualquer uma delas combinando as outras. Considerando que o número de componentes para tal sistema é 3: eles são CaCO 3 , CaO e CO 2 . Esta informação também nos permite calcular o número de componentes independentes: n = o número de componentes – o número de equações independentes, e assim: n = 3 – 1 = 2 Podemos usar o mesmo exemplo para calcular o número de graus de liberdade usando a equação para a regra de fase de Gibbs: s = n – f + 2 = 2 – 3 + 2 = 1 Este valor indica que para manter uma quantidade estável de fases no equilíbrio do sistema, podemos operar apenas uma variável intensiva. 
Sistemas heterogêneos
Qualquer sistema que inclua mais de uma fase (portanto, um sistema não homogêneo) também é heterogêneo. O tipo das fases é irrelevante; um sistema heterogêneo pode conter ao mesmo tempo várias fases sólidas e líquidas, mas apenas uma fase gasosa. Isso se deve ao fato de que os gases se misturam de maneira perfeita. Um exemplo interessante de sistema heterogêneo é o granito – contém muitas fases sólidas, incluindo quartzo, feldspato potássico, plagioclásio e biotita. Muitos produtos alimentícios também podem ser chamados de heterogêneos, exemplos perfeitos são muesli com vários ingredientes ou molhos para salada que consistem em gordura, especiarias e outros aditivos. Um tipo interessante de misturas não homogêneas são os colóides (soluções cujos constituintes só podem ser distinguidos com um microscópio). No entanto, na maioria dos casos, eles podem ser separados com métodos ou ferramentas simples. Por exemplo, para separar uma mistura composta por água e óleo, podemos usar a decantação – os ingredientes serão visíveis a olho nu. Outros métodos que podemos usar para separar efetivamente misturas não homogêneas incluem: filtração, segregação mecânica ou centrifugação. É semelhante para uma mistura de minerais que diferem em propriedades: quartzo, mica e feldspato podem ser separados mesmo com um martelo.
Sistemas homogêneos
Ao contrário dos sistemas heterogêneos, um sistema homogêneo é caracterizado pela presença de apenas uma fase. Nesse caso, não podemos distinguir os constituintes a olho nu. Métodos simples de separação também são ineficazes, e apenas métodos baseados em características físicas podem ser úteis. Um exemplo desse método é a separação por destilação, que se baseia em pontos de ebulição diversificados de um sistema específico. Outros métodos eficazes na separação de misturas homogêneas são a cristalização e a cromatografia. Um tipo especial de sistema homogêneo é uma substância pura cuja única fase contém apenas um componente. Outro exemplo são todos os tipos de soluções e misturas homogêneas – apesar da presença de apenas uma fase, o sistema pode incluir muitos componentes. Como a fase presente no sistema pode ser um líquido, um sólido ou um gás, as soluções também podem assumir essas formas. Exemplos de tais sistemas são misturas líquidas (vinagre, água), misturas gasosas (ar atmosférico) e misturas sólidas, incluindo minérios e todos os tipos de ligas, como bronze ou latão.
Transições em sistemas
Dois tipos de transições podem ocorrer em sistemas, sendo elas transições de fase (às vezes chamadas de físicas) e transições químicas. Os primeiros incluem todas as transições que não produzem novas substâncias químicas. Eles também não são caracterizados pelo desbotamento dos componentes já presentes. No entanto, como o nome indica, eles levam a mudanças na estrutura ou no estado físico. Também é possível que uma nova fase seja formada enquanto a fase original desaparece. Exemplos de transições de fase incluem ressublimação e transições polimórficas de elementos. As transições químicas mostram um mecanismo completamente diferente. São reações que produzem novas substâncias que substituem os constituintes originais. Tais transições podem ser realizadas em duas variantes, por exemplo durante a hidrólise em uma ou mais fases, bem como durante a queima.
Reações químicas
- Reações homogêneas ocorrem quando todo o sistema, incluindo substratos e produtos, está em uma fase, por exemplo:
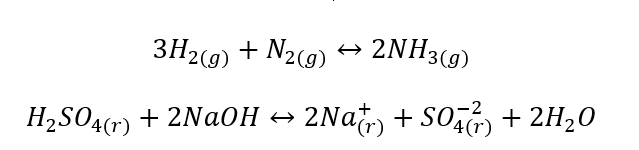
- As reações heterogêneas são aquelas em que o sistema, incluindo substratos e produtos, está pelo menos em duas fases diferentes. Tais reações sempre ocorrem na interface, por exemplo: