O termo “tampões de pH” refere-se a soluções aquosas que não alteram seu valor de pH, apesar da introdução de uma pequena quantidade de bases ou ácidos, ou durante a diluição. Em termos práticos, são misturas de soluções de ácidos fracos e seus sais com bases fortes concentradas (doador de próton – aceptor de próton) ou, analogamente, misturas de soluções de bases fracas e seus sais com ácidos fortes. O principal objetivo do uso de soluções tampão é que elas atuem como agentes que permitem manter o valor do pH em um nível razoavelmente estável. Eles são frequentemente usados em uma ampla gama de aplicações químicas, por exemplo, na fabricação de corantes, durante processos de fermentação, bem como para determinar o valor do pH de produtos alimentícios, cosméticos e farmacêuticos.
A equação de Henderson-Hasselbach
A principal dependência do valor do pH do tampão no pK a ou pK b usado para o ácido ou base, respectivamente, bem como a razão das concentrações do ácido e sua base conjugada ou, analogamente, a base e seu ácido conjugado, é definida pela equação de Henderson-Hasselbach. Ele mostra a correlação entre a força do ácido aplicado e o valor do pH. Para uma amostra de reação de um tampão produzido com um ácido fraco, o procedimento é o seguinte: HA + H 2 O ↔ H 3 O + + A – Considerando que a correlação entre [A –], ou seja, a concentração molar da base conjugada [mol ·dm -3], [HA], sendo a concentração molar do ácido não dissociado e o pK a – o logaritmo negativo da constante de equilíbrio de dissociação do ácido (K a ), expresso com a equação de Henderson-Hasselbach para tal reação, tem a seguinte forma: 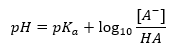
A equação de Henderson-Hasselbach para um tampão de acetato
O mecanismo de funcionamento dos tampões é baseado na presença de íons, que são capazes de se ligar aos íons hidrogênio ou hidróxido. Ao considerar um tampão de acetato, que é uma mistura de ácido acético e acetato de sódio, devemos observar a reação de dissociação entre um ácido acético fraco e um eletrólito forte, acetato de sódio (CH 3 COONa), que é completamente dissociado em íons: CH 3 COOH ↔ H + + CH 3 COO – CH 3 COONa → CH 3 COO – + Na + Como a solução tampão é uma mistura desses íons, a adição de uma pequena quantidade de um ácido forte introduz [H + } } íons, que são imediatamente ligados por ânions CH 3 COO – para formar ácido acético que não é dissociado nessas condições. Em consequência, isto reduz o valor do pH. Da mesma forma, o fornecimento de cátions OH – adicionais pela introdução de uma base forte na solução não aumentará o nível de pH. Eles serão imediatamente ligados por íons H + provenientes da dissociação do ácido acético em moléculas de água não dissociadas. A equação que define a constante de dissociação ácida é apresentada abaixo: 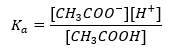 Para a dissociação do ácido acético fraco, a concentração total do ânion CH 3 COO – é definida pela concentração de íons provenientes da dissociação do sal, que, por sua vez, é igual à concentração do sal (c s ), ou seja, acetato de sódio. Uma alta concentração desses ânions faz com que a concentração de cátions H + diminua e, consequentemente, o grau de dissociação do ácido é reduzido para manter o valor de K a estável. Devido a esta relação, também podemos supor que o número de moléculas de CH 3 COOH não dissociadas é praticamente idêntico à concentração total de ácido acético (c k ). É por isso que a constante de dissociação pode ser anotada da seguinte forma:
Para a dissociação do ácido acético fraco, a concentração total do ânion CH 3 COO – é definida pela concentração de íons provenientes da dissociação do sal, que, por sua vez, é igual à concentração do sal (c s ), ou seja, acetato de sódio. Uma alta concentração desses ânions faz com que a concentração de cátions H + diminua e, consequentemente, o grau de dissociação do ácido é reduzido para manter o valor de K a estável. Devido a esta relação, também podemos supor que o número de moléculas de CH 3 COOH não dissociadas é praticamente idêntico à concentração total de ácido acético (c k ). É por isso que a constante de dissociação pode ser anotada da seguinte forma: 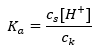 Tendo tomado o logaritmo, obtemos uma relação que leva à equação de Henderson-Hasselbach:
Tendo tomado o logaritmo, obtemos uma relação que leva à equação de Henderson-Hasselbach: 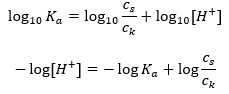 Assim, a equação de Henderson-Hasselbach tem a seguinte forma:
Assim, a equação de Henderson-Hasselbach tem a seguinte forma: 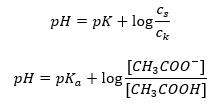 Para escrever as relações, o valor de pKa na equação é de fato a medida da força do ácido. Quaisquer valores de pKa menores que 3 (-log(0,001)) são característicos de ácidos fortes, enquanto quanto maior o valor, mais fraco é o ácido. O fato resultante da equação de Henderson-Hasselbach é a equivalência entre o valor do pH da solução tampão e o pK a do ácido no momento em que a razão entre a concentração do ácido não dissociado e a concentração do ânion produzido pela dissociação do ácido é igual a 1, pois log(1) é igual a 0. Tais condições existem como resultado da titulação de um ácido fraco com uma base forte, se adicionarmos uma quantidade de base que corresponda à metade da quantidade necessária para a neutralização completa do ácido. Então o grau de titulação da solução é 50%. Na dependência entre o pH e o volume do titulante usado, o valor do pH na área tampão muda relativamente lentamente.
Para escrever as relações, o valor de pKa na equação é de fato a medida da força do ácido. Quaisquer valores de pKa menores que 3 (-log(0,001)) são característicos de ácidos fortes, enquanto quanto maior o valor, mais fraco é o ácido. O fato resultante da equação de Henderson-Hasselbach é a equivalência entre o valor do pH da solução tampão e o pK a do ácido no momento em que a razão entre a concentração do ácido não dissociado e a concentração do ânion produzido pela dissociação do ácido é igual a 1, pois log(1) é igual a 0. Tais condições existem como resultado da titulação de um ácido fraco com uma base forte, se adicionarmos uma quantidade de base que corresponda à metade da quantidade necessária para a neutralização completa do ácido. Então o grau de titulação da solução é 50%. Na dependência entre o pH e o volume do titulante usado, o valor do pH na área tampão muda relativamente lentamente. 
Exemplo: tampão de amônio
Outro tipo de tampão é o tampão de amônio, que é uma mistura de uma base fraca (NH 4 OH) com um ácido forte (NH 4 Cl). No entanto, o mecanismo é muito semelhante. O sal presente na mistura sofre dissociação completa, sendo sua constante a seguinte equação: 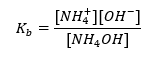 Já a base amoniacal é praticamente não dissociada no eletrólito forte (NH 4 Cl). Por esta razão, assumimos que a concentração do cátion NH 4 + é igual à concentração do sal, mas a concentração de moléculas de NH 4 OH não dissociadas é idêntica à concentração da base. Isso permite formular a equação e calcular o pH desse tampão.
Já a base amoniacal é praticamente não dissociada no eletrólito forte (NH 4 Cl). Por esta razão, assumimos que a concentração do cátion NH 4 + é igual à concentração do sal, mas a concentração de moléculas de NH 4 OH não dissociadas é idêntica à concentração da base. Isso permite formular a equação e calcular o pH desse tampão. 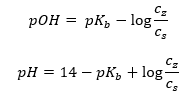 Os íons NH 4 + e Cl – e as moléculas de NH 4 OH presentes no tampão de amônio fazem com que, uma vez adicionado um ácido ou uma base, ocorram as seguintes reações: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Se a adição for pequena, a alteração na proporção da concentração de sal-base e, portanto, a alteração do pH, também é pequena. No caso de uma mudança de dez vezes na proporção dessas concentrações, o valor do pH mudará em uma unidade.
Os íons NH 4 + e Cl – e as moléculas de NH 4 OH presentes no tampão de amônio fazem com que, uma vez adicionado um ácido ou uma base, ocorram as seguintes reações: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Se a adição for pequena, a alteração na proporção da concentração de sal-base e, portanto, a alteração do pH, também é pequena. No caso de uma mudança de dez vezes na proporção dessas concentrações, o valor do pH mudará em uma unidade.
Capacidade do buffer
O termo” capacidade tampão” refere-se à capacidade de uma solução tampão para manter uma acidez aproximadamente constante de uma solução. Mais precisamente, é o número de equivalentes-grama de um ácido forte ou base forte que, quando adicionado a 1 dm 3 de uma solução tampão, altera seu valor de pH em um. A fórmula que define a capacidade tampão (β) inclui sua dependência do número de moles de um ácido/base forte após a adição à solução tampão (Δn, [ml]) e a mudança no pH observada ao adicionar o volume de um ácido ou base forte para a solução tampão (ΔpH). ![]() É um valor fortemente relacionado com as concentrações dos ingredientes, que sobe à medida que aumentam. O maior valor da capacidade tampão caracteriza as soluções tampão cujo pH é igual à constante de dissociação (pK a ) do ácido utilizado para produzi-las.
É um valor fortemente relacionado com as concentrações dos ingredientes, que sobe à medida que aumentam. O maior valor da capacidade tampão caracteriza as soluções tampão cujo pH é igual à constante de dissociação (pK a ) do ácido utilizado para produzi-las.
Princípio de funcionamento de um tampão de fosfato
Um tipo menos popular de tampões são aqueles que contêm dois sais ácidos. Neste caso, são dois sais ácidos do ácido ortofosfórico (V), ou seja, fosfato de sódio monobásico (V) e fosfato de sódio dibásico (V). Ao contrário dos tampões mais comuns, que também são baseados no princípio de Brønsted de pares ácido-base conjugados, a natureza dos ingredientes não é tão fácil de determinar. Como os ânions presentes no tampão fosfato apresentam valores característicos dos ácidos de Brønsted, devemos verificar com mais cuidado a diferença entre eles. De acordo com esse princípio, o íon sendo o ácido mais forte deve ter uma constante de dissociação mais alta.
- Para H 2 PO 4 – K a = 6,34·10 -8
- Para HPO 4 -2 K a = 4,36·10 -13
Se tivermos esses dados disponíveis, podemos afirmar facilmente que, nesse caso, é o ânion de hidrogênio H 2 PO 4 -13 que é o ácido de Brønsted fraco. O mecanismo de funcionamento do buffer é baseado em um equilíbrio dinâmico que pode ser expresso pela seguinte equação: ![]() Se adicionarmos pequenas quantidades de ácido à solução tampão, o sistema tentará evitar as mudanças no pH devido à reação de bloquear o efeito dos cátions [H +] protonando o ânion hidrogênio, conforme a seguir equação:
Se adicionarmos pequenas quantidades de ácido à solução tampão, o sistema tentará evitar as mudanças no pH devido à reação de bloquear o efeito dos cátions [H +] protonando o ânion hidrogênio, conforme a seguir equação: ![]() O fato de ser o ânion que vai neutralizar os tampões adicionados à solução é consequência do fato de ser esse ânion a base de Brønsted mais forte. Em tais sistemas, aplicamos uma regra que diz que quanto mais forte o ácido de Brønsted, mais fraca é sua base conjugada. Se adicionarmos um ácido a um sistema contendo várias bases de Brønsted, então a base mais forte será a primeira a reagir. Esta relação é o componente mais importante quando se analisam os equilíbrios existentes em misturas de soluções tampão aquosas constituídas por uma mistura de ácidos de Brønsted e uma mistura de bases fracas de Brønsted. A mesma regra, mas na ordem inversa, se aplica quando adicionamos uma solução básica a um tampão fosfato. Os ânions OH – serão quase imediatamente capturados pelo ácido de Brønsted mais forte presente no tampão. Neste caso, este será o íon, e a reação ocorrerá de acordo com a seguinte equação:
O fato de ser o ânion que vai neutralizar os tampões adicionados à solução é consequência do fato de ser esse ânion a base de Brønsted mais forte. Em tais sistemas, aplicamos uma regra que diz que quanto mais forte o ácido de Brønsted, mais fraca é sua base conjugada. Se adicionarmos um ácido a um sistema contendo várias bases de Brønsted, então a base mais forte será a primeira a reagir. Esta relação é o componente mais importante quando se analisam os equilíbrios existentes em misturas de soluções tampão aquosas constituídas por uma mistura de ácidos de Brønsted e uma mistura de bases fracas de Brønsted. A mesma regra, mas na ordem inversa, se aplica quando adicionamos uma solução básica a um tampão fosfato. Os ânions OH – serão quase imediatamente capturados pelo ácido de Brønsted mais forte presente no tampão. Neste caso, este será o íon, e a reação ocorrerá de acordo com a seguinte equação: ![]()
Buffers conhecidos e suas aplicações
- O sangue mantém os valores de 7,35 e 7,45 unidades, e sua estabilidade é garantida pela presença de ácido carbônico, principalmente na forma de dióxido de carbono dissolvido e HCO 3- É um tampão sendo um ácido fraco e seu sal, e qualquer adição de uma quantidade excessiva de ácidos ou bases causará condições perigosas para a vida humana. Um exemplo semelhante de tampão é a saliva, cujo pH é em torno de 7.
- Tampões de amônio, acetato, fosfato e borato, respectivamente:
- NH 3 + NH 4 Cl pH = 8 – 11;
- CH 3 COOH + CH 3 COONa pH 3,5 – 6;
- K 2 HPO 4 + KH 2 PO 4 pH = 5,5 – 8;
- H 3 BO 3 + Na 2 B 4 O 7 pH = 7 – 9.
Todos os tampões populares são aplicados onde é crítico manter o pH em um nível constante, por exemplo:
- na medicina, onde são administrados por via intravenosa a pacientes em estado crítico;
- em culturas microbianas, onde a reação do solo é um fator importante;
- ao trabalhar com enzimas e proteínas, para estabilizar o ambiente para reações químicas;
- na galvanoplastia, onde são utilizados para banhos eletrolíticos, pois permitem evitar alterações rápidas e críticas de seu pH na região próxima ao eletrodo;
- para calibrar medidores de pH.
























































































































