Спектроскопические методы - это группа методов, в которых получаемый сигнал возникает при взаимодействии электромагнитного или корпускулярного излучения с исследуемым образцом. Такое излучение может возникать в результате периодических изменений электромагнитного поля, связанных с передачей энергии. Эти методы направлены на определение концентрации или содержания атомов в данной поглощающей или излучающей системе. Какие типы спектрофотометрии мы различаем и из чего эти методы состоят? Об этом вы узнаете из нашей статьи.

Излучение и энергетические переходы
Важнейшим свойством фотонов, или квантов излучения, является энергия. Уравнение для величины энергии (E) представляет собой произведение универсальной постоянной Планка (h), равной 6,626-10-34 [Дж-с], и частоты излучения (v), выраженной в герцах [Гц].
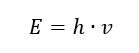
Спектрофотометрия использует энергетические переходы, происходящие в молекулах при поглощении или испускании электромагнитного излучения в различных диапазонах:
- ультрафиолет (УФ) 200-380 нм,
- видимое излучение (Vis) 380-780 нм,
- ближний инфракрасный диапазон (ИК) 0,78-30000 мкм.
Основные понятия и законы, связанные со спектрофотометрией.
Изобестическая точка
Это точка, соответствующая определенной длине волны, полученной в результате пересечения кривых, построенных в системе «поглощение — длина волны», где обе формы соединения в растворе (диссоциированная и недиссоциированная) имеют одинаковое поглощение. Изменение pH не приводит к изменению положения, у соединения может быть много таких точек.
Спектр поглощения химического соединения
Этот спектр представляет собой меру количества света, поглощенного соединением с длиной волны света (λ). Если на образец падает электромагнитное излучение (свет) интенсивностью I0, то часть этого излучения поглощается, а часть проходит сквозь образец. Регистрируя интенсивность падающего излучения (I0) и прошедшего излучения (It), мы можем определить количество света, которое поглощается раствором (поглощение, А) или проходит через него (пропускание, Т).
Поглощение
Величина, описывающая явление абсорбции это поглощения. Это безразмерная величина интенсивности электромагнитного излучения по отношению к количеству свободных атомов. Эта величина была введена для облегчения расчетов, связанных с объемами абсорбции. Абсорбцией называется взаимодействие между электромагнитным излучением и веществом — поглощение части энергии веществом. Поглощение является аддитивной и иногда называется оптической плотностью. Символически записывается как Abs или A. Математически это десятичный логарифм отношения интенсивности пучка излучения, падающего на испытуемый образец (I0), к интенсивности пучка излучения, проходящего через испытуемый образец(It). Он может принимать значения от 0 до бесконечности. Математическое выражение, описывающее эту зависимость, называется Законом Бугера — Ламберта — Бера. Поглощение при определенной длине волны зависит от коэффициента абсорбции (ε), толщины поглощающего слоя (обычно 1 см) и концентрации исследуемого раствора.
Пропускание
Иначе известный как коэффициент пропускания, представляет собой отношение излучения, проходящего через образец(It), к излучению, падающему на образец (I0), которое равно излучению, проходящему через образец. Чаще всего выражается в процентах и может составлять от 0% до 100%. Пропускание выражается формулой:
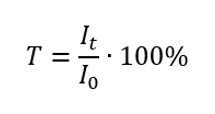
Связь между поглощением и пропусканием выражается следующим образом:
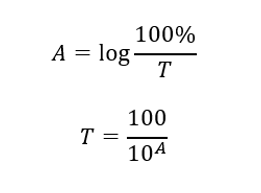
Закон Ламберта
Он гласит, что поглощение пропорционально толщине поглощающего слоя однородного образца. Мы можем записать его как отношение коэффициента абсорбции (k) и толщины измеряемого слоя образца (l):
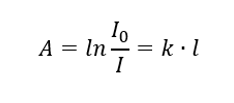

Закон Бугера-Ламберта-Бера
Касается абсорбции излучения растворами и может быть сформулирована следующим образом: если коэффициент абсорбции растворителя равен нулю, то поглощение монохроматического пучка излучения, проходящего через однородный раствор, прямо пропорционально концентрации (c) раствора и толщине поглощающего слоя (l). Закон Бугера-Ламберта-Бера — это определение абсорбции, которое можно записать следующим образом:
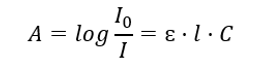
Молярный коэффициент абсорбции (ɛ) — это характерная величина для вещества в определенном растворителе и при определенной длине волны. Он пропорционален вероятности переходов между энергетическими уровнями молекулы и напрямую зависит от энергии фотонов излучения. Численно представляет поглощение раствора с концентрацией 1 моль/дм3 при толщине поглощающего слоя 1 см. Знание коэффициента позволяет определить концентрацию тестового раствора после измерения величины поглощения. По желанию, ожидаемое поглощение раствора может быть рассчитана на основе соотношения и концентрации. Основное применение формулы — определение концентрации вещества с известным молярным коэффициентом поглощения и эмпирически измеренной абсорбцией. Это можно сделать по формуле или с помощью калибровочной кривой, построенной для данного вещества в нескольких точках в предполагаемом диапазоне концентраций. Действительно, мы можем представить закон Бугера-Ламберта-Бера как концентрационную зависимость поглощения: A = f(C).
Закон аддитивности
Закон Бугера-Ламберта-Бера относится к случаю, когда в растворе находится одно поглощающее вещество. Однако если в многокомпонентном растворе находится больше веществ, поглощающих излучение при выбранной длине волны, то поглощение этого раствора (A) равно сумме поглощений его отдельных компонентов(A1,A2,…), т.е. A=A1+A2+⋯+An. Стоит отметить и запомнить, что поглощение каждого компонента — это произведение его концентрации и соответствующего молярного коэффициента поглощения. Это 3-й закон поглощения, используемый в спектрофотометрическом анализе многокомпонентных систем.
Отступления от законов поглощения
Необходимым условием выполнения законов поглощения является то, что излучение, воздействующее на систему, должно быть монохроматическим, а его интенсивность — не слишком высокой. Причины отклонения от закона Бугера-Ламберта-Бера могут быть следующими:
- несовершенство измерительных приборов, в результате чего условие не выполняется,
- химические реакции, происходящие во время измерения, например, полимеризация, гидролиз, конденсация,
- мутность раствора.
Применение электронных спектров поглощения
- Он позволяет определить тип электронных переходов, исследуя спектры в растворителях разной полярности.
- Различия в положении и интенсивности полос поглощения различных молекулярных форм используются для изучения равновесий, устанавливающихся между ними в растворе (структурные исследования, таутомерные равновесия).
- Используется для определения соединений на основе закона Бугера-Ламберта-Бера.
- Используется как дополнительный метод идентификации, основанный на положении λmax тестируемых веществ.
- Они используются при определении чистоты исследуемых соединений — смещая положение максимума поглощения, сравнивая отношение значений поглощения в двух разных точках спектра.

Электронная спектроскопия УФ-Вид
Для изучения явления поглощения UV-Vis спектрофотометрия является особенно интересным методом, позволяющим проводить качественный и количественный анализ многих веществ. Явление радиационного поглощения используется, когда: поглощение линейно зависит от концентрации или когда поглощение аддитивно, т.е. для многокомпонентного раствора оно является суммой поглощений его компонентов. Условия соблюдены, если в системе нет межмолекулярных взаимодействий.
Анализируя спектры поглощения УФ-Вид, возникающие при прохождении электромагнитного излучения через раствор, можно наблюдать переходы валентных электронов из основного в возбужденное состояние. Это явление приводит к поглощению (абсорбции) части излучения на определенных длинах волн. Поглощение следует за переходом этих электронов на более высокие энергетические уровни, но для того, чтобы это произошло, кванты электромагнитного излучения должны обладать достаточной энергией, чтобы уравновесить разницу энергий между энергетическими уровнями. В молекулах такие энергии составляют несколько электрон-вольт, что точно соответствует частоте УФ-Вид.
Хромофоры
Соединения, демонстрирующие поглощение в диапазоне УФ-Вид, имеют в своей структуре хромофоры, то есть группы атомов, электроны которых характеризуются низкими энергиями возбуждения. Другими словами, хромофор — это часть молекулы (группа атомов), отвечающая за избирательное поглощение излучения в видимом диапазоне (180-800 нм) и, следовательно, за возникновение цвета. К ним относятся: ароматические кольца (ароматический электронный секстет), кратные связи (часть из них — связи π-типа), как между атомами углерода, так и между другими, например, карбонильная группа C=O.
Ауксохромы
Другая группа атомов — это ауксохромы, то есть заместители, которые не проявляют поглощения в УФ-Вид диапазоне, но их присутствие вызывает изменения в спектрах поглощающих элементов. Они усиливают действие хромофоров, что мы часто можем наблюдать в виде гораздо более интенсивного окрашивания испытуемого вещества, чем в отсутствие их в системе. Кроме того, мы разделяем ауксохромы на батохромы, например, -NH2, -OH, которые смещают максимум поглощения в сторону более длинных волн, и гипохромы, например, -CH3, -CO, которые смещают максимум в сторону более коротких волн.
Атомно-абсорбционная спектрометрия ASA
Это еще одна техника, использующая феномен поглощения. С его помощью химические элементы определяются в виде образцов в любом состоянии (жидком, твердом, газообразном), а само измерение основано на наблюдении за поглощением излучения определенной длины волны свободными атомами металла. Основа метода заключается в том, что атом может поглощать электромагнитное излучение только на той длине волны, на которой он также может его испускать, и это характерно только для данного элемента. Чем выше энергия, подводимая к атому, тем больше электронов возбуждается на более высоких уровнях и тем большее количество линий наблюдается в спектре. Если подводимая энергия соответствует потенциалу ионизации атома, образуются ионы, такие как Na+. В основе количественного анализа методом атомно-абсорбционной спектрометрии лежит пропорциональность поглощения числу поглощающих атомов и закон Бугера-Ламберта-Бера.