По своему химическому строению алканы относятся к группе углеводородов. Это соединения, содержащие только два типа атомов - углерод и водород. Они состоят из основного углеродного скелета и прикрепленных к нему атомов водорода. В случае алканов все связи одинарные, поэтому их называют предельными (насыщенными) углеводородами.

Гомологический ряд
Представители алканов, расположенные в порядке возрастания числа атомов водорода в структуре, образуют гомологический ряд. Он начинается с метана, содержащего один атом углерода, и заканчивается деканом с 10-тью атомами углерода. Номенклатура алканов исходит из числа атомов углерода, описанных греческими или латинскими числами, присутствующих в структуре, и характерного окончания -ан, например, гептан, нонан и т. д.
Общая формула алканов: , где «n» — число атомов углерода (C), присутствующих в цепи, а «H» — водород.
| Число атомов углерода, присутствующих в цепи | Формула алкана | Название алкана |
| 1 | CH4 | Метан |
| 2 | C2H6 | Этан |
| 3 | C3H8 | Пропан |
| 4 | C4H10 | Бутан |
| 5 | C5H12 | Пентан |
| 6 | C6H14 | Гексан |
| 7 | C7H16 | Гептан |
| 8 | C8H18 | Октан |
| 9 | C9H20 | Нонан |
| 10 | C10H22 | Декан |
Типы насыщенных углеводородов
По строению цепи алканы делятся на:
-
Прямолинейные (парафиновые)
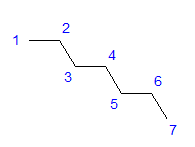
Рис. 1 Структурная формула гептана
Все атомы углерода имеют sp3-гибридизацию. Из-за тетрагонального угла между связями необходимо зигзагообразное расположение атомов углерода. Молекулы могут принимать различное расположение, потому что они могут свободно вращаться вокруг одной связи между атомами углерода. Чем больше число атомов углерода в данной структуре, тем больше возможностей для разнообразия форм цепи.
-
Изоалканы, или насыщенные углеводороды разветвлённого строения
Образование углеводородов разветвлённого строения происходит в результате соединения атома углерода более чем с двумя другими атомами углерода. На месте такого соединения образуется разветвление. Углеводороды разветвлённого строения – изомеры углеводородов с прямой цепью.
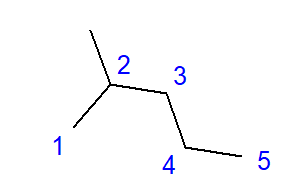
Рис. 2 Структурная формула 2-метилпентана
Формула 2-метилпентана, показанная на рис. 2, имеет всего шесть атомов углерода и является изомером гексана. Название «2-метилпентан» означает, что цепь пентана имеет метильную группу, присоединенную ко второму положению углерода. По мере увеличения числа атомов углерода в молекуле увеличивается число возможных конституциональных изомеров. Например, гексан может иметь 5 различных изомеров, октан имеет 18 таких возможностей, а декан — 75.
-
Циклические углеводороды — циклоалканы, алициклические углеводороды
Возможно замыкание цепной структуры с образованием колец, состоящих из повторяющихся элементов –CH2-. Названия образованы от названия алкана с приставкой цикло-, например циклобутан, циклогептан. Кстати, они изображаются в виде правильных многоугольников.
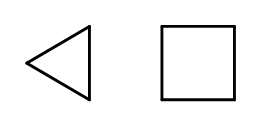
Рис. 3 Слева направо: циклопропан, циклобутан
Существуют также замещенные кольца, в названии которых упоминаются заместители. В этом случае нумерация атомов углерода определяется таким образом, чтобы заместители располагались как можно ниже.
Ведущие представители группы
Метан представляет собой соединение с общей формулой CH4, начинающий гомологический ряд алканов. Углерод четырехвалентный и, следовательно, имеет четыре связи C-H. При комнатной температуре это газ, без запаха и цвета. Поскольку атом углерода демонстрирует sp3-гибридизацию, его структура имеет форму тетраэдра, а образующиеся орбитали вместе с четырьмя атомами водорода образуют равноценные связи.
Этан является следующим алканом в ряду, общая формула которого C2H6. Записывая полуструктурную формулу H3C-CH3, можно увидеть, что с каждым из атомов углерода соединяются три атома водорода. Подобно метану и другим низшим углеводородам, это газ без цвета и запаха. Связи C-H относятся к фронтальному типу — сигма sp-s, а одинарная связь между атомами углерода представляет собой фронтальную связь — сигма sp-sp.
Синтез алканов
- Гидрирование алкенов или алкинов

- Гидролиз соединений Гриньяра
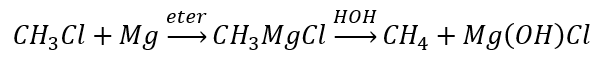
- Восстановление алкилгалогенидов

- Реакция Вюрца
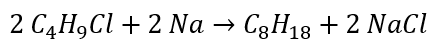
Восстановление альдегидов и кетонов
- Редукция Клемменсена
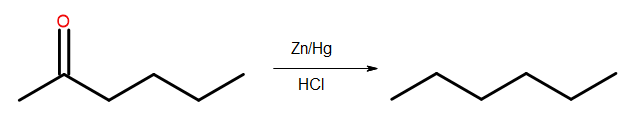
Рис. 4 Схема редукции Клемменсена
- Реакция Кижнера-Вольфа
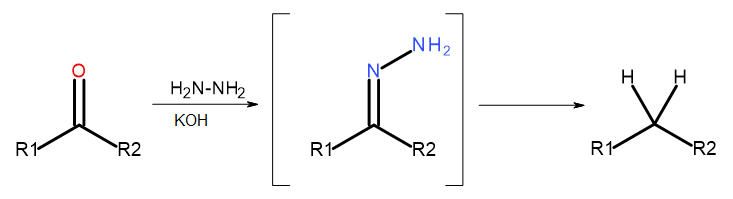
Рис. 5 Схема редукции Кижнера-Вольфа
Физико-химические свойства алканов
Алканы с короткой цепью от C1 до C4 при комнатной температуре представляют собой газы. С другой стороны, другие гомологи, начиная с пентана, представляют собой жидкости с повышающейся температурой кипения. Наличие разветвлений в структурах приводит к более низкой температуре кипения изомеров. С увеличением длины углеродной цепи происходит зависимость добавления еще одной группы –CH2— в структуру и более высокой температуры кипения — примерно на 20-30oC. Физическое состояние алканов от октадекана и выше — твердое вещество с температурой плавления от 28oC для n-октадекана. Твердые углеводороды – парафины, а следующие — жидкости, являющиеся основными компонентами парафинового масла.
Гидрофобный характер молекул алканов означает, что они не смешиваются с водой, не смачиваются ею и не растворяются в ней. С другой стороны, их сродство к неполярным средам позволяет им легко растворяться самим по себе и в подобных неполярных, средне- и низкополярных органических растворителях. Растворимость алканов в двух распространенных спиртовых растворителях, то есть в метаноле и этаноле, относительно хорошая. В метаноле алканы хорошо растворяются только до определенной концентрации. При ее превышении происходит расслоение фаз. В этаноле низшие алканы растворяются очень легко, а высшие алканы растворяются несколько хуже.
Все углеводороды являются легковоспламеняющимися веществами. Углеводороды, представляющие собой газы, а также пары жидких углеводородов, при соединении с воздухом образуют смеси со взрывоопасным потенциалом.
Реакционная способность алканов относительно низкая из-за отсутствия потенциально реакционноспособных функциональных групп. Связи между атомами углерода C-C, а также между атомами углерода C-H и атомами водорода очень устойчивы к разрыву. Энергии этих связей составляют соответственно 88 ккал/моль и 104 ккал/моль. Только при определенных условиях они могут бурно реагировать.
Реакции алканов
- Полное сгорание — с выделением углекислого газа
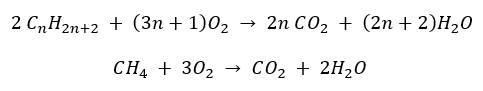
- Полусгорание — при ограниченном доступе кислорода, с выделением оксида углерода
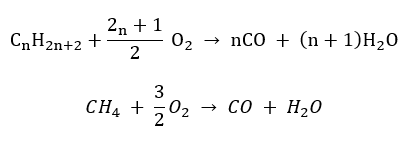
- Неполное сгорание – при очень ограниченном доступе кислорода образуется сажа
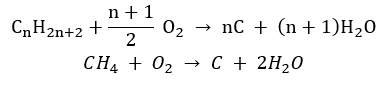
- Реакция замещения (радикальное галогенирование — на примере реакции метана с хлором, при участии света)
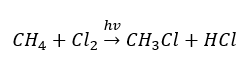
- Пиролиз, то есть разложение алканов на более мелкие частицы под действием очень высокой температуры. В зависимости от процесса может произойти крекинг, гидрокрекинг или изомеризация.
- Нитрование азотной кислотой (V) с образованием смеси продуктов — изомеров, обладающих заместителем-NO2 в различных местах.
- Двухстадийное сульфирование, при котором мерсолы являются промежуточным продуктом, а мерсолаты — конечным продуктом.