Среди органических химических соединений, относящихся к ненасыщенным углеводородам, можно выделить группу под названием алкины. Они принадлежат к этому семейству соединений благодаря своему строению - молекула содержит только атомы углерода и водорода, а одна из связей между атомами углерода ненасыщенная. В случае алкинов, это тройная связь C≡C. Мы можем найти многих представителей группы в повседневных продуктах, например, в бензине, чернилах, пестицидах, а также в косметике, где они играют роль антиоксидантов.

Строение алкинов
Общая формула алкинов — CnH2n-2, и каждый из них содержит минимум одну тройную связь. Структурно они представляют собой изомеры диенов, циклоалкенов и бициклических циклоалкенов. Алкины, как и алканы или алкены, имеют прямую или разветвленную цепную структуру. Кроме тройной связи, являющейся ковалентной связью, существуют и другие, одинарные, но тоже ковалентные связи между атомами углерода С-С и атомами углерода и водорода C-H. Тройная связь возникает только тогда, когда два последовательных атома углерода пространственно расположены в линейной sp-гибридизации. Длина этой связи составляет примерно 0,120 нм. Например, в этине один гибрид углерода соединяется с орбиталью атома водорода с образованием ковалентной связи сигма sp-s (δsp-s). Второй соединяется с аналогичной сигма-связью sp-sp (δsp-sp), создавая еще один гибрид, который соединяется с атомом водорода. Такие преобразования приводят к образованию линейного скелета молекулы. Из-за возникающей sp-гибридизации также есть две p-орбитали, перпендикулярные оси связи, из которых в конечном итоге образуются две π-связи между атомами углерода. Вращения вокруг тройной связи не наблюдается.
Присвоение названий алкинам
Есть несколько основных принципов, которые следует учитывать при присвоении названий этим химическим соединениям:
- Само наличие ненасыщенной тройной связи в структуре обозначается в виде окончания „-ин” после согласных х, ф, г, к, л, заменяющего окончание „-ан” в названии соответствующего гомолога-алкана. В тех случаях, когда возможно несколько положений для такой связи, всегда перед окончанием «-ин» стоит соответствующая цифра, представляющая локант связи, например, гепт-2-ин или гепт-1-ин. Локант также может использоваться в начале названия, например, 1-бутин.
- В случае структур, содержащих более одной тройной связи, к окончанию добавляется приставка для обозначения их количества. Это могут быть -ди, -три и т. д.
- Нумерация атомов углерода должна иметь такое направление, чтобы основная цепь содержала как можно больше атомов углерода и тройную связь.
- В случае, если единственной ненасыщенной связью является тройная связь — атомы углерода нумеруются так, чтобы она имела как можно более низкий локант. Правило не применяется, если имеются и другие ненасыщенные двойные связи. Тогда их локанты должны быть как можно ниже.
- В названии соединения с одной тройной связью, расположенного рядом с первым локантом, цифра может быть опущена, то есть можно использовать название проп-1-ин, но также и пропин.
Физико-химические свойства алкинов
Природа алкинов неполярна, они гидрофобны и реагируют с водой. Лучше всего они растворяются в аналогичных неполярных растворителях, таких как алканы. По мере увеличения углеродной цепи их температура плавления, температура кипения и плотность увеличиваются. При этом снижается их активность. Наиболее реакционноспособными являются соединения с малым числом атомов углерода в цепи. По сравнению с алканами и алкенами они несколько более реакционноспособны из-за меньшей стабильности тройной связи по сравнению с одинарной или двойной связью. Их молекулярная структура также приводит к высокой воспламеняемости этих соединений. Одной из характерных реакций, которым подвергаются алкины, является реакция горения. Они способны присоединять электрофильный реагент в месте ненасыщенной связи. Они подвергаются реакции полимеризации.
Гомологический ряд алкинов
Подобно алканам и алкенам, алкины также имеют свой гомологический ряд, то есть свою иерархию основных соединений, содержащих одну тройную связь, упорядоченную по возрастанию числа атомов углерода в структуре. Соединение, которое начинает гомологический ряд алкинов, представляет собой этин, также известный как ацетилен, который имеет в своей структуре два атома углерода и два атома водорода
| Число атомов углерода, присутствующих в цепи | Формула алкана | Название алкана | Формула алкина | Название алкина |
| 2 | C2H6 | Этан | C2H2 | Этин |
| 3 | C3H8 | Пропан | C3H4 | Пропин |
| 4 | C4H10 | Бутан | C4H6 | Бутин |
| 5 | C5H12 | Пентан | C5H8 | Пентин |
| 6 | C6H14 | Гексан | C6H10 | Гексин |
| 7 | C7H16 | Гептан | C7H12 | Гептин |
| 8 | C8H18 | Октан | C8H14 | Октин |
| 9 | C9H20 | Нонан | C9H16 | Нонин |
| 10 | C10H22 | Декан | C10H18 | Децин |
Получение алкинов на примере этина
- Реакция карбида с водой
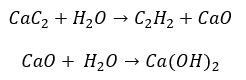
- Пиролиз
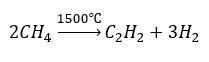
- Синтез с использованием высоких температур
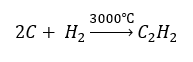
- Частичное окисление природного газа
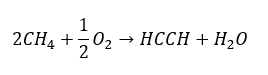
Высшие алкины в промышленных масштабах получают, используя в качестве реагента этин и, например, формальдегид в реакции конденсации. Другой метод заключается в двукратном удалении галогеноводорода из соответствующих алкилгалогенидов, содержащих два атома галогена, прикрепленных к одному атому углерода или к соседним. Во втором случае возможны два продукта — алкин и диен. Пример реакции образования пропина:
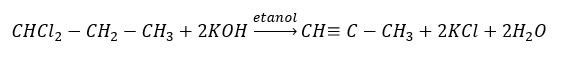
Характерные реакции алкинов
- Полное сгорание с образованием углекислого газа
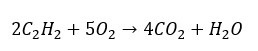
- Частичное сгорание с образованием окиси углерода или сажи
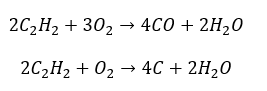
- Реакция гидрирования в присутствии металлических катализаторов Pd, Pt, Fe, Ni, в результате которой образуются алкены. Может происходить поэтапно, с присоединением дополнительных отдельных молекул водорода, или полностью, с образованием алкана.
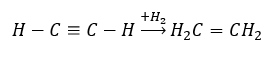
- Реакция Кучерова, характерная для алкинов, заключающаяся в присоединении молекулы воды вблизи тройной связи, протекающая в два этапа. Первоначально образуется нестабильный енол, представляющий собой комбинацию алкена и спирта. Затем он подвергается кето-енольной таутомерии, то есть перегруппировке с образованием альдегидов или кетонов. Изменение протекает по электрофильному механизму.
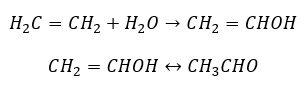
- Реакция электрофильного присоединения с HCl или HBr, происходящая по правилу Марковникова. Это может происходить полностью или в несколько этапов.
- Электрофильное присоединение брома с образованием ди- или тетрабромпроизводных. Из-за реакции с бромом алкины обесцвечивают бромную воду. Аналогично они также реагируют с молекулами хлора.
- Свободнорадикальная реакция присоединения галогенов, протекающая под действием световой энергии
- Реакции замещения, в результате которых атом водорода, расположенный рядом с атомом углерода тройной связи, вытесняется атомом металла
- Тримеризация, т.е. полимеризация с участием трех молекул, с использованием ацетилена позволила синтезировать бензол.