Аминокислоты представляют собой группу органических соединений, структурная строение которых состоит из атомов углерода, азота, водорода и кислорода, а также из переменной группы боковой цепи. Они являются бифункциональными соединениями, а в их молекулах содержатся карбоксильные группы COOH и аминогруппы NH2.

Общая формула аминокислот такова:
NH2 – R — COOH
Название является сокращением полного термина «α-аминокарбоновая кислота». Когда речь заходит о различных типах аминокислот, чаще используют общепринятые названия соединений, а не систематические. Например, аминоуксусная кислота — это глицин, 2-аминопропаноиновая кислота — аланин, а 2-амино-3-метилбутановая кислота — валин.
Классификация аминокислот
Основная классификация аминокислот — классификация на белковые и небелковые. Первая группа состоит примерно из 20 соединений, каждое из которых входит в состав белков и имеет огромное значение для человеческого организма. Эти белки, которые также встречаются в качестве строительных материалов в растениях и животных, играют фундаментальную роль, участвуя во многих механизмах, ответственных за поддержание гомеостаза в человеческом организме. При другом способе классификации учитывается способность производить ту или иную аминокислоту или необходимость поставлять ее вместе с пищей в организм человека.
Экзогенные и эндогенные аминокислоты
Экзогенные аминокислоты — это органические соединения, которые необходимы для гомеостаза в организме, но не способны к самовоспроизводству. Поэтому их необходимо поставлять в виде соответствующего рациона, вместе с надлежащим образом сбалансированными блюдами и в виде подходящих добавок. В эту группу аминокислот входят:
- Лизин — противовирусная и повышающая иммунитет аминокислота;
- Метионин, который регулирует выработку гормона роста;
- Треонин, отвечающий за поддержание надлежащего увлажнения кожи и правильное функционирование нервной системы;
- Лейцин, основная функция которого — регулировать уровень секреции кортизола, уровень сахара и поддерживать заживление ран;
- Изолейцин — аминокислота, участвующая в механизмах метаболизма в мышечных тканях;
- Валин, который поддерживает регенерацию мышц и способствует сбрасыванию лишнего жира;
- Триптофан — прекурсор серотонина, который, как считается, улучшает качество сна и повышает настроение, а также регулирует аппетит;
- Фенилаланин, который является прекурсором многочисленных важных для организма гормонов, включая тирозин, дофамин, адреналин и норадреналин.
Вторая категория аминокислот — это эндогенные аминокислоты, синтез которых происходит в организме человека регулярно, так что потребность в них постоянно покрывается самодостаточным образом. В эту группу входит большее количество аминокислот, в том числе:
- Аланин, который является аминокислотой, отвечающей за транспортировку глюкозы к красным кровяным тельцам и мозгу;
- Аспаргиновая кислота, которая улучшает умственную деятельность и повышает способность к концентрации внимания;
- Аспарагин, который поддерживает многочисленные процессы, такие как обучение, запоминание и улучшение концентрации;
- Глутаминовая кислота, которая поддерживает пищеварительные процессы, а также снижает утомляемость и поддерживает память.
Условно незаменимые аминокислоты
Это соединения, которые могут вырабатываться в организме, но только при наличии достаточного количества их прекурсоров. К ним относятся:
- Аргинин, который задерживает процесс старения, влияет на скорость заживления ран и повышает физическую работоспособность;
- Цистеин, который является строительным материалом при образовании глутатиона и важным элементом в производстве коллагена;
- Глютамин, который поддерживает работу кишечника и очищает организм от ненужных отходов обмена веществ;
- Тирозин, который, как и цистеин, участвует в производстве коллагена, также необходим для синтеза меланина и способствует поддержанию гомеостаза щитовидной железы;
- Глицин, который является аминокислотой с терапевтическим потенциалом для лечения артрита и диабета;
- Орнитин, который обладает способностью снижать уровень кортизола, улучшать качество сна, а также улучшать работу кишечника и пищеварительных ферментов;
- Пролин, который способствует хорошему состоянию кожи и повышению ее эластичности;
- Серин, направленный на процессы, поддерживающие иммунную систему и функцию нейронов.
Белковые аминокислоты
Как следует из названия, существуют также аминокислоты, которые являются компонентами белков. Точнее говоря, белки — это соединенные между собой аминокислоты различных типов. Их двадцать, и в процессе синтеза они кодируются так называемыми кодонами (последовательностями из трех нуклеотидов, содержащихся в мРНК и составляющих кодирующую единицу). У каждого из них есть две общие черты — это альфа- и L-аминокислоты. Это означает, что их аминогруппа присоединена к альфа-углероду, непосредственно примыкающему к карбонильной группе. Буква «L», с другой стороны, обозначает стереоизомер в проекции Фишера, поэтому аминогруппа находится в левой части формулы.
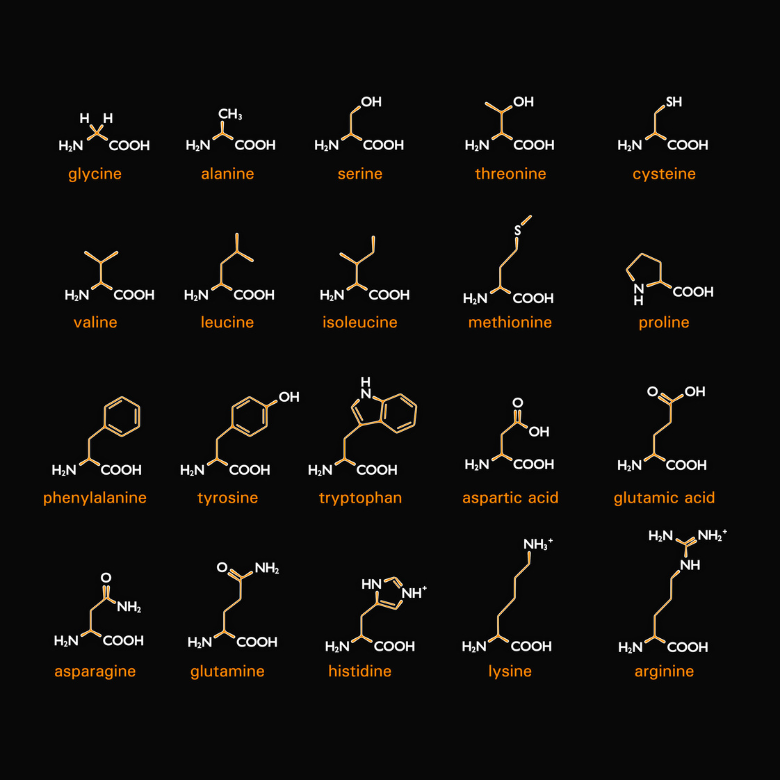
Физико-химические свойства аминокислот
Физическая форма аминокислот в основном представляет собой кристаллическое твердое вещество со сладким вкусом. Их растворимость в воде хорошая, но они не растворяются в органических растворителях. Их температуры плавления относительно высоки. Химическая природа аминокислот амфотерна, а реакция водных растворов нейтральна. При диссоциации образуются амфотерные ионы в результате нейтрализации основной аминной группы карбоксильным остатком. В результате образуется внутренняя аммониевая соль, которая имеет как положительный, так и отрицательный заряд. Их количество равно друг другу. В зависимости от среды, в которой диссоциирует аминокислота, она может существовать в виде катиона или аниона. В случае кислой реакции карбоксильная группа не диссоциирует, и аминокислота приобретает положительный заряд. Напротив, в щелочной среде реакция сдвигается в сторону образования отрицательно заряженного иона.
Изоэлектрическая точка
Это точка, в которой аминокислота принимает форму амфотерного иона. Для каждой молекулы можно установить соответствующую концентрацию ионов [H3O+], т.е. рН, при котором не происходит миграции ионов в электрическом поле. Амфотерность аминокислот и их нахождение в форме амфотерного иона приводит к ионной структуре соли при воздействии кислот и щелочей. Экспериментальное определение изоэлектрической точки осуществляется путем добавления аминокислоты, например, казеина, в подходящие пробирки с растворами (CH3COOH i CH3COONa) известных концентраций pH. Достижение изоэлектрической точки наблюдается там, где присутствует наиболее обильный осадок. Благодаря характеристике изоэлектрической точки, ее можно использовать для разделения смеси белков с помощью электрофореза. Метод основан на кислотно-основных свойствах аминокислот, а смесь помещается на увлажненную бумагу. Используя известный pH, мы можем определить, в какой форме будут присутствовать конкретные аминокислоты. Затем, при подаче напряжения на бумагу, положительно заряженные аминокислоты будут двигаться к катоду (-), а аминокислоты с отрицательным зарядом — к аноду (+). Нейтрально заряженные соединения, уравновешенные положительными и отрицательными зарядами в молекуле, останутся на прежнем месте.
Реакции, характерные для карбоксильной группы
- Этерификация, которая заключается в синтезе сложных эфиров, образующихся в результате реакции аминокислоты со спиртом. Продукт реакции не является амфотерным по своей природе, но проявляет свойства используемого амина.
- Декарбоксилирование, которое представляет собой нагревание аминокислоты в присутствии раствора гидроксида бария(II) (Ba(OH)2). В результате этого превращения образуются амины.
- Комплексообразование, это способность аминокислот соединяться с катионами металлов, главным образом — меди, в процессе чего образуются цветные соединения — комплексные соли.

Реакции, характерные для аминной группы
- Деаминирование, в котором участвуют аминокислоты, содержащие в своей структуре первичную аминогруппу. Реакция происходит под действием азотной кислоты (III) —HNO2, и аминокислота, используемая в качестве реагента, окисляется с образованием гидроксикислоты (оксикислоты). Аминогруппа высвобождается в виде азота. Существует несколько типов дезаминирования, включая гидролитическое, гидролитическое с декарбоксилированием, дезаминирование путем восстановления и десатурационное.
- Окисление, при котором аминокислоты превращаются в кетокислоты.
- Биохимические реакции — все аминокислоты, которые могут быть классифицированы как основания Шиффа, проявляют потенциал для биохимических превращений, таких как трансмитация и декарбоксилирование.
Реакции для обнаружения аминокислот
- Нингидриновая реакция — это цветная реакция, в которой реагентами являются аминокислота и реактив в виде раствора нингидрина. В результате реакции получается характерный фиолетово-синий цвет.
- Ксантопротеиновая реакция является примером пути для обнаружения ароматических аминокислот, таких как, например, фенилаланин, тирозин или триптофан. В результате воздействия на соединение концентрированным раствором азотной кислоты (V) — HNO3 наблюдается желтый цвет. Это связано с образованием в ходе реакции нитропроизводных аминокислот.
Источники аминокислот
Для хорошего психического и физического здоровья человеческого организма необходимо обеспечить достаточное количество каждого строительного материала, включая аминокислоты. Полноценные пищевые белки являются очень важным источником всех аминокислот, необходимых для правильного функционирования. К ним относятся мясо, в частности, птица и рыба, яйца и молочные продукты. В молоке можно найти большое количество лейцина, изолейцина, треонина и триптофана. Лизин и метионин содержатся в сое. Валин поступает в организм с рисом, арахисом, кунжутом и миндалем, а фенилаланин — путем введения в рацион яиц, сыра и зерновых продуктов. Наличие аминокислот в продуктах питания — обычное явление, однако для достижения сбалансированного питания следует использовать самые разнообразные продукты, поскольку они содержат лишь часть аминокислот, необходимых для поддержания нормальной жизнедеятельности организма.