Элементы — это атомы, в ядре которых содержится конкретное количество протонов. Кроме них, атомное ядро состоит и из других молекул — нейтронов. Именно их количество может отличаться в пределах одного элемента. В данном случае речь идет об изотопах, т. е. вариантах данного элемента, имеющих в своем ядре разное количество нейтронов. Поэтому они имеют разные массовые числа. Однако атомное число остается постоянным, поскольку число электронов в электронных оболочках не меняется.

По этой причине в периодической таблице химических элементов изотопы данного элемента занимают одинаковое место, и каждый из них характеризуется одинаковой величиной. Их химические и физические свойства также схожи. Однако есть исключения, когда, в частности, физические характеристики более разнообразны, как правило, при рассмотрении изотопов с большими различиями в массе. Это связано с тем, что целый ряд свойств, таких как плотность или скорость диффузии частиц, зависит от массы. Однако такие параметры, как электропроводность и цвет, не зависят от нее. Различия в химических свойствах обычно связаны с неодинаковой скоростью реакции отдельных изотопов.
Нуклиды в сравнении с изотопами
Это понятие, связанное с изотопами, но немного более общее. Нуклиды — это совокупность атомов, структура ядра которых строго определена количеством протонов и нейтронов. Это означает, что изотопами могут быть два нуклида с разным количеством нейтронов. На практике все изотопы являются нуклидами, но не все нуклиды обязательно являются изотопами. Основная идея этих двух понятий связана с химическими свойствами в случае изотопов и ядерными свойствами в случае нуклидов. Например:
- Нуклиды, которые являются изотопами:
- Нуклиды, которые не являются одновременно изотопами:
Изотопы в природе
Встречающиеся в природе химические элементы представляют собой смесь изотопов с постоянным процентным составом. В зависимости от ядра в составе может быть один или более изотопов. Некоторые из них стабильны, а некоторые меняются очень быстро. Этот распад может давать изотопы одного и того же элемента или разных элементов. Такие переходы обычно сопровождаются испусканием излучения. При условии использования конкретных значений на Земле существуют элементы с атомными числами меньше или равными 92. Те, у которых максимальное значение составляет до 83, считаются постоянными. Встречающихся в природе элементов, у которых есть стабильные изотопы, — 81. К ним относятся кремний с изотопами 28Si, 29Si и 30Si, железо с изотопами 54Fe, 56Fe, 57Fe и 58Fe и алюминий, имеющих только один стабильный изотоп — 27Al.
Изотопы водорода
В природе встречаются три изотопа водорода, образующие смесь элемента. На практике изотопы 1H (водород-1) и 2H (водород-2) составляют большую часть, соответственно 99,985 % и 0,015 %, от общего количества водорода. Изотоп 3H (водород-3) нестабилен и представляет собой только следовые количества. Водород-1 является наиболее известным протием, водород-2, также известный как дейтерий, состоит из одного протона и одного нейтрона, а последний изотоп водород-3, то есть тритий, имеет в ядре один протон и два нейтрона. По этой причине разница в массе между ними очень значительна — атом дейтерия имеет вдвое большую массу, чем протий, а тритий, по сравнению с протием, имеет втрое большую массу. Как известно, водород в любой изотопной форме представляет собой двухатомную молекулу. Оказывается, он также может образовывать молекулы, содержащие разные изотопы, т. е. типа HD (протий-дейтерий), HT (протий-тритий) и DT (дейтерий-тритий). Дейтерий — это нерадиоактивный изотоп с высокой стабильностью. Его можно найти под названием тяжелый водород. Замена водорода-1 на дейтерий в молекуле воды (D2O) изменяет ее свойства — температура плавления повышается примерно на 1,5 °С, а температура замерзания — на 3,81 °С. Его плотность также выше, чем у H2O, примерно на 0,1 %. А вот тритий — это очень нестабильный изотоп, который является радиоактивным. В его ядре происходят спонтанные радиоактивные распады, в результате которых образуются атомы гелия. Сравнивая физико-химические свойства изотопов, можно обнаружить принципиальные различия, представленные в таблице 1.
Таблица 1. Сравнение основных физико-химических параметров изотопов водорода.
| Изотоп | Символ | Плотность [г/л] | Температура плавления [К] | Температура кипения [К] |
| Протий | H | 0,08233 | 13,83 | 20,27 |
| Дейтерий | D | 0,1645 | 18,73 | 23,67 |
| Тритий | T | 0,2464 | 20,62 | 25,04 |
Изотопы углерода
Элемент углерода имеет три известных изотопа: 12C, 13C и 14C, и каждый из них обладает одинаковыми химическими свойствами. Наиболее распространенным является углерод-12, на долю которого приходится 98,89 % всех атомов. Изотоп 13C встречается на Земле примерно в 1,11 %, а последний, атом 14С, — примерно в 1012. Последний имеет предрасположенность к самопроизвольному распаду, приводящему к испусканию бета-излучения. Затем он превращается в атом азота. Стабильным изотопом является углерод-13. Из-за ненулевого спина этот изотоп можно применять в ядерном магнитном резонансе 13 ЯМР.
Применение изотопов
В детекторах дыма применяют нестабильные изотопы 241Am или 238Pu, которые характеризуются медленным распадом в сочетании с излучением. При появлении дыма происходит блокировка излучения, которое перестает достигать детектора, что вызывает тревогу. Благодаря способности излучения распада некоторых элементов к уничтожению микроорганизмов изотопы, в том числе 60Co, можно применять для консервирования пищевых продуктов. В медицинской диагностике некоторые ядра используют для обнаружения изменений в обследуемых органах, например в почках или сердце. Такой изотоп соединяется с биологически неактивным веществом известным путем в организме и вводит его в кровоток. Это позволяет отслеживать путь излучения и наблюдать его накопление в тканях и органах. Лучевая терапия, основанная на излучении нестабильных изотопов, таких как 226Ra и 60Co, также применяется при лечении опухолей. Целью такой терапии является уничтожение опухолевых клеток. Один из изотопов углерода, 14С, применяют для определения возраста материалов органического происхождения. Это нестабильное ядро медленно распадается, и в случае гибели организма, когда прекращается процесс ассимиляции углерода, концентрация в нем углерода-14 с течением лет пропорционально уменьшается. Некоторые изотопы, например 239Pu и 235U, применяют на атомных электростанциях. При распаде этих нестабильных ядер вырабатывается энергия, которая, в свою очередь, может быть преобразована в электричество.
Атомная масса и изотопы
Атомная масса элементов, показанная в периодической таблице химических элементов, на самом деле является усредненной массой. При ее расчете учитывают количество (n) и процентный состав (xn) отдельных изотопов данного элемента по формуле:
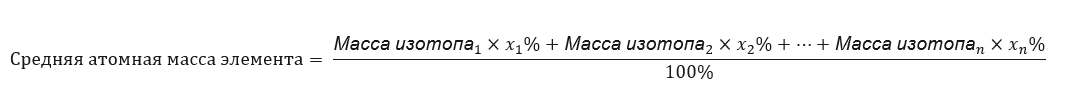
Например, расчет средней атомной массы водорода дает следующее уравнение:
