Это один из старейших инструментальных методов, применяемых в химическом анализе. Основы этого метода заложили Л. Гальвани, А. Вольта, Дж. В. Гиббс и В. Нернст на рубеже XVIII–XIX веков. В потенциометрических методах применяется электродвижущая сила (ЭДС) ячейки, состоящей из двух электродов, погруженных в исследуемый раствор во время измерений. Величина этой силы напрямую зависит от потенциалов применяемых электродов. Они, в свою очередь, зависят от активности ионов, находящихся в растворе электролита, и от природы электродных процессов.
Схема электродных процессов на примере ячейки Даниэля
Ячейка Даниэля состоит из двух полуячеек, каждая из которых состоит из металла, погруженного в раствор своей соли. Строительными полуячейками является система Cu(s)/Cu2+(aq) и Zn(s)/Zn2+(aq). На каждой из них происходит одна из окислительно-восстановительных реакций:
- процесс восстановления
Cu2+(aq) + 2e— → Cu(s)
- процесс окисления
Zn(s) → Zn2+(aq) + 2e—
Объединив эти две реакции, мы получим полное уравнение реакции, происходящей в ячейке:
Zn(s) + Cu2+(aq) + 2e— → Zn2+(aq) + 2e— + Cu(s)
Чтобы измерить интересующую электродвижущую силу ячейки, необходимо соединить полуячейки электролитическим ключом и подключить электроды к вольтметру. Это позволяет измерить разность потенциалов между отдельными электродами, которая является величиной электродвижущей силы (ЭДС) ячейки. Согласно конвенции IUPAC (Международный союз теоретической и прикладной химии), схема ячейки Даниэля выглядит следующим образом:
ϴZn|Zn2+||Cu2+|Cu⊕
Одиночные линии символизируют границы фаз, а двойная линия — электролитический ключ. Потенциал, возникающий на границе фаз, является результатом протекающих реакций окисления и восстановления. Принимается, что электрод ячейки, на котором происходит окисление, является анодом ϴ, а другой электрод ячейки — положительным катодом, на котором происходит реакция восстановления. На схеме запись начинается с анода, а катод записывается справа. Электродвижущая сила такой ячейки может быть рассчитана по формуле:
ЭДС = потенциал катода — потенциал анода
Стандартный электродный потенциал
Это понятие было введено для надлежащей систематизации, а определенный электродный потенциал, чтобы быть стандартным потенциалом, должен удовлетворять нескольким условиям. Измерение необходимо выполнять при температуре 298 К, активность активных ионов должна быть равна 1 моль/дм3, а в качестве электрода сравнения необходимо применять стандартный водородный электрод. Это происходит потому, что потенциал этого электрода принимается равным 0,0000 В.
Электродвижущая сила ячейки
Значение электродвижущей силы изменяется с изменением активности ионов, присутствующих в ячейке. Уравнение, отражающее эту взаимосвязь, называется уравнением Нернста:
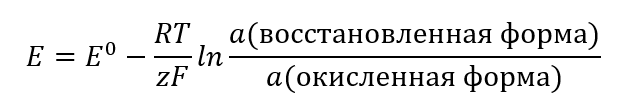
В уравнении применяются следующие символы: электродного потенциала (E0), стандартного электродного потенциала (E0), газовой постоянной (R), равной 8,312 Дж/К моль, температуры (T), числа электронов, присутствующих в электрохимической реакции (z), постоянной Фарадея (F) 9,64853·104 C/моль, а также активности ионов восстановленной и окисленной форм. Для твердых веществ активность (a) принимается за 1.

Потенциометрическая аппаратура
Основная установка для потенциометрических измерений состоит из двух частей — пары электродов, погруженных в исследуемый раствор, и измерительного прибора. Первая часть представляет собой измерительную ячейку, а вторая часть позволяет правильно измерить ее электродвижущую силу. Самой важной частью ячейки являются электроды. В зависимости от механизма действия их можно классифицировать на четыре группы.
Электролитический ключ
Важным компонентом любой системы ячейки является электролитический ключ, который обеспечивает контакт между электродом сравнения и исследуемым раствором. Основным свойством ячейки с переносом является контакт между электролитами различных концентраций и составов. Для обеспечения несмешиваемости между электролитом ключа и исследуемым раствором применяются небольшие площади контакта.
Электроды первого типа
Это электроды из металла или газа, погруженные в раствор собственных ионов. Их иначе называют катион-обратимыми электродами, поскольку на них происходит обратимая реакция:
M0 ↔ Mn+ + ne
Примером электрода первого типа является водородный электрод.
Электроды второго типа
Такие электроды изготавливаются из металла, покрытого его труднорастворимой солью. Система погружается в хорошо растворимую соль, которая имеет тот же анион, что и малорастворимая соль. Они называются обратимыми электродами по отношению к общему аниону, потому что на них происходит реакция:
M0 + A— ↔ MA + e
Примерами электродов второго типа являются хлорсеребряный электрод и каломельный электрод.

Электроды третьего типа
Их образуют металлы, окруженные двумя слоями: первым — тонким слоем труднорастворимой соли этого металла и вторым — чуть лучше растворимой соли, содержащей тот же самый анион. Они являются обратимыми электродами по отношению к общему катиону, так как реакция происходит на них:
M0(a) + M(b)A ↔ M(a)A + M+(b) + e
Окислительно-восстановительные электроды
Конструкция электродов этого типа характеризуется применением химически инертного металла, такого как платина или золото, который погружается в раствор, содержащий вещество в восстановленной и окисленной форме. Примером такого электрода является хингидронный электрод.
Функции электродов в системе
С точки зрения применения в аналитической системе существуют следующие электроды:
- сравнительные, также известные как электроды сравнения. Это те электроды, которые поддерживают постоянный потенциал, не зависящий от условий измерения или концентрации исследуемого раствора.
- индикаторные электроды, которые реагируют изменением потенциала при обнаружении в исследуемом растворе ионов, к которым они чувствительны.
Сравнительные электроды
Потенциометрическое измерение основано на сравнении потенциала индикаторного электрода с электродом сравнения. Поэтому такие электроды должны характеризоваться:
- постоянством потенциала;
- воспроизводимостью потенциала и отсутствием температурной зависимости;
- универсальностью применений и простотой использования;
- низким электрическим сопротивлением;
- воспроизводимым и низким диффузионным потенциалом;
- низкой утечкой электролита электрода в исследуемый раствор.
Обычно применяемым электродом сравнения является хлорсеребряный электрод Ag/AgCl/KCl, который реагирует на присутствие хлорид-ионов. Он изготовлен из серебряной проволоки, покрытой слоем хлорида серебра. Другим примером является каломельный электрод Pt/Hg/Hg2Cl2/KCl, потенциал которого также зависит от активности в растворе хлорид-ионов.
Индикаторные электроды
Электроды этой категории показывают изменение потенциала в присутствии исследуемых ионов в растворе. Это означает, что их потенциал напрямую зависит от активности и, следовательно, концентрации раствора, в котором они находятся. Наиболее часто применяются электроды, погруженные в растворы собственных ионов, такие как серебряные, ртутные и водородные электроды. Однако в современной потенциометрии применяются ионоселективные мембранные электроды. Они имеют общие черты, такие как: активной частью является мембрана, ионная реакция между ионами из раствора и мембраной определяет разность потенциалов на границе раздела этих фаз. По конструкции такие электроды можно разделить на: стеклянные, с неподвижными мембранами, с жидкими мембранами и с двойными мембранами. Наиболее часто применяемыми электродами являются стеклянные электроды, конструкция которых состоит из стеклянной трубки, заканчивающейся тонкостенным пузырьком из электродного стекла. Внутри него находится внутренний электрод — хлорсеребряный электрод, погруженный во внутренний раствор с постоянной активностью ионов.