В химии мы часто используем такие термины, как «концентрированный раствор», «разбавленный раствор» и «насыщенный раствор», но они дают нам лишь приблизительное представление о том, много или мало вещества в растворе. Однако есть несколько способов точно определить, каков его количественный состав. Об одном из них Вы прочтете в следующей статье.

Определение процентной концентрации
Понятие концентрации означает величину количества вещества, находящегося в данном растворе. Концентрация может быть указана в единицах в зависимости от размера, который мы используем, например, в молях, граммах или процентах. Процентная концентрация говорит нам, сколько массовых частей растворенного вещества содержится в 100 массовых частях раствора. Другими словами, это количество граммов растворенного вещества в 100 г раствора. Например, если мы покупаем молоко 3,2%, это означает, что в 100 г молока содержится 3,2 г жира. Процентная концентрация обозначается символом «C%».
Общая формула для процентной концентрации
Чтобы вывести формулу процентной концентрации, следует помнить, что масса раствора (мр-ра) — это не только масса растворителя (мр-ля), но и растворенного в нем вещества (мв-ва):
мр-ра = мр-ля + мв-ва
Взяв в качестве примера 4-процентный раствор массой 100 г, мы знаем, что C% = 4%, значит масса вещества равна 4 г. Из определения процентной концентрации следует, что, поскольку масса раствора составляет 100 г, масса растворителя составляет 96 г.
Процентная концентрация может быть рассчитана по формуле:
C% = (мв-ва/мр-ра) · 100%
Из формулы следует, что, зная массу раствора и массу вещества, мы можем легко вычислить процентную концентрацию. Например, зная, что раствор имеет массу 450 г, а растворенного вещества в нем 15 г, подставив в формулу, получим:
C% = (15/450) · 100% = 3,3%
Расчет массы отдельных компонентов раствора
Любая формула, в том числе формула процентной концентрации, может быть преобразована. Зная процентную концентрацию раствора и его массу, можно рассчитать массу растворенного в нем вещества. Аналогично, зная процентную концентрацию и массу вещества, можно рассчитать массу раствора. В дополнение к преобразованиям формулы можно также использовать соответствующие пропорции.
Пример 1. Сколько граммов сахара потребуется для приготовления 300 г 10%-го раствора?
Из содержания задания мы знаем, что масса раствора 300 г и его процентная концентрация 10 %. Определение массы растворенного вещества возможно двумя способами.
Способ 1. Преобразование формулы
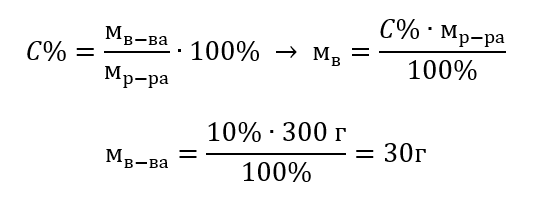
Способ 2. Использование пропорции, зная, что 10%-ый раствор содержит 10 г сахара в 100 г раствора
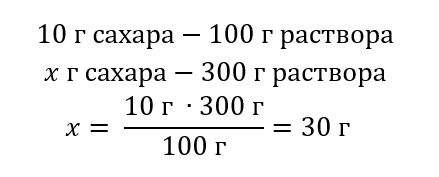
Результатом обоих способов решения является то, что для приготовления 300 г 10%-ого раствора необходимо использовать 30 г сахара.

Пример 2. В скольких граммах воды надо растворить 10 г вещества, чтобы получить 50%-ый раствор?
Из содержания задания мы знаем, что масса вещества 10 г, а процентная концентрация раствора 50 %. Это означает, что в 100 г раствора содержится 50 г вещества. Определение массы раствора возможно двумя способами. Следует помнить, что масса раствора не равна массе растворителя. Для расчета массы растворителя из массы раствора следует вычесть массу вещества.
Способ 1. Преобразование формулы

Способ 2. Использование пропорции, зная, что в 100 г раствора содержится 50 г вещества.
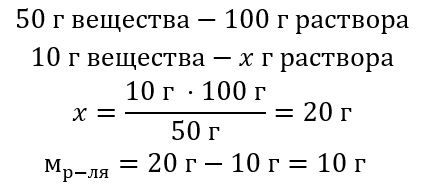
Решение задания двумя способами заключается в том, что для получения 50%-ого раствора необходимо растворить 10 г вещества в 10 г воды.
Приготовление растворов
Ключевым элементом лабораторной работы является способность готовить растворы с заданными концентрациями. Для этого необходимо знать массы его компонентов. Рассчитанную ранее массу вещества следует растворить в точно отмеренном объеме растворителя. Необходимый объем можно рассчитать, зная массу и плотность жидкости. Плотность раствора – физическая величина, характерная для данной жидкости, определяющая ее массу для конкретной единицы объема. Значение сильно зависит от температуры. Зная, что плотность раствора равна 2,03 г/мл, мы знаем, что 1 мл данного раствора имеет массу 2,03 г. Наиболее распространенными единицами плотности являются: г/мл = г/см3, г/л = г/дм3, но могут встречаться и другие единицы, например кг/м3. Плотность раствора определяется по формуле: dр-ра=мр-ра/vр-ра, где mр-ра означает массу раствора, а Vр-ра – его объем. Зная объем данного раствора и его плотность, можно вычислить его массу.
Пример 3. Какую массу имеет 20 мл раствора, плотность которого составляет 1,201 г/мл?
Способ 1. Преобразование формулы
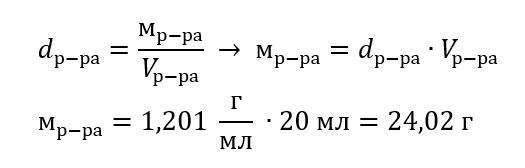
Способ 2. Использование пропорции, зная, что 1,201 г раствора занимает объем 1 мл

Оба способа показали, что раствор с плотностью 1,201 г/мл, занимающий 20 мл, имеет массу, равную 24,02 г.
Знание понятия плотности позволяет нам проводить еще больше расчетов по процентной концентрации.
Пример 4. Сколько граммов соли содержится в 10 мл раствора с концентрацией 15%, если его плотность составляет 1,035 г/мл?
Способ 1. Преобразование формул

Способ 2. Использование пропорции

Оба способа показали, что для приготовления 10 мл раствора с C% = 15%, плотностью 1,035 г/мл необходимо взвесить 1,553 г соли.
Пример 5. Какова процентная концентрация раствора, полученного при растворении 40 г вещества в 200 мл этанола плотностью 0,78 г/мл?
Для расчета задания можно использовать преобразование формулы в процентную концентрацию. Мы можем рассчитать массу раствора, сложив массу растворенного вещества и массу растворителя. В связи с тем, что в содержании задания не указана масса растворителя, а даны его плотность и объем, то путем преобразования формулы в плотность можно вычислить недостающие данные.
