Диссоциация в химическом контексте — это распад вещества на другие молекулы. Это слово происходит от латинского слова «dissociatio», что означает «разделение». В научной номенклатуре диссоциация принимает различные определения, поскольку она встречается и в такой области, как психология. Мы, однако, сосредоточимся на значении диссоциации в химии. В зависимости от процесса и используемого в нем вещества мы можем выделить различные типы диссоциации. Наиболее распространенной является электролитическая диссоциация, однако термическая диссоциация также является не менее важным процессом.

Термическая диссоциация
Этот процесс включает в себя распад молекул на более мелкие молекулы или атомы под воздействием температуры. Наиболее важной взаимосвязью здесь является то, что используемая температура диссоциации может быть ниже, если в соединении имеются более слабые химические связи. Те, у которых энергия, необходимая для диссоциации, выше, требуют более высокой температуры. Примером, с которыми мы часто сталкиваемся для реакций термолиза (термической диссоциации) является карамелизация сахарозы, которая происходит при температуре 160 oC.
Электролитическая диссоциация
Это немного более сложный процесс по сравнению с термической диссоциацией, открытый шведским химиком Сванте Аррениусом в 1887 году. Электролитическая диссоциация подразумевает диссоциацию вещества, происходящую под воздействием растворителя, обычно воды, на свободно движущиеся ионы. Аррениус в своих исследованиях показал, что ионы, образующиеся при таком типе диссоциации, вызывают электрический ток, проходящий через данный раствор. Это также привело к разделению химических веществ на электролиты, то есть растворы, способные проводить электрический ток, и неэлектролиты — растворы, которые не проводят электричество.
Электролиты
Определение «электролиты» имеет двоякое значение — с технической точки зрения, это любое вещество, способное ионно переносить заряд между электродами. В результате он может ионически проводить электрический ток. Второе же, более химическое значение электролитов, относится к веществам, которые подвергаются электролитической диссоциации в результате плавления или растворения. Такие растворы, обычно водные, также являются электропроводящими. Примерами таких электролитов могут быть как ионные соединения, такие как хлорид натрия (поваренная соль), так и неионные соединения, такие как хлористоводородная кислота и гидроксид калия. Благодаря своим особым свойствам электролиты можно назвать проводниками электричества. Они, в свою очередь, делятся на проводники первого типа: металлы и их сплавы и углерод — и проводники второго типа: растворы оснований, кислот и солей.
Механизм электролитической диссоциации
В растворителе, диэлектрическая проницаемость которого высока (например, для воды равна 81), силы взаимного притяжения между ионами кристаллической решетки сильно ослаблены. Затем они разрываются, что приводит к растворению вещества с выделением свободно движущихся ионов в раствор. Такие процессы также происходят из-за взаимодействия между ионами и молекулами воды, что обусловлено полярной структурой H2O. Механизм действия воды, при разложении электролита с ионной структурой по Некрасову, начинается с положительного иона вещества, который притягивает противоположный полюс молекулы воды, одновременно отталкивая положительный полюс. Противоположный полюс взаимодействует таким же образом, и молекулы воды, притягиваемые обоими ионами, собираются вокруг них. Это притяжение является взаимным между дипольными молекулами и ионами, поэтому притягивающая сила ионов в электролите значительно ослабевает. Поэтому механизм можно разделить на три основные стадии — переход полярной структуры в ионную, образование ионной структуры и гидратация ионов. Связи, образующиеся при диссоциации между ионами и растворителем, называются сольватами. Если растворителем является вода — гидратами.
Гидратационная оболочка
Это так называемая оболочка, состоящая из молекул воды, находящихся в непосредственной близости от иона и обращенных к полюсам противоположного знака. Свободные заряженные полюса притягивают последовательные слои воды до тех пор, пока притяжение через ион не станет слабее энергии движения молекул в растворе. Оболочка облегчает диссоциацию молекул электролита на катионы и анионы и обеспечивает барьер, затрудняющий рекомбинацию ионов в молекулы.

Диссоциация кислот и оснований — закон действия масс
Сильной кислотой называется кислота, которая в водном растворе показывает далеко продвинутую диссоциацию, а слабой кислотой — та, которая диссоциирует незначительно. При сравнении силы различных кислот необходимо также учитывать несколько факторов, например, склонность молекул кислоты к отдаванию протонов или тоже концентрацию рассматриваемого вещества. Однако существует химическая величина, которая не зависит от концентрации, но прекрасно характеризует индивидуальные свойства молекул —- константа диссоциации. Вывод уравнения для этой величины следует начать с составления уравнения диссоциации кислоты. Для однопротонного примера HX это будет выглядеть следующим образом:
![]()
Если раствор разбавлен и кислота слабая, то может быть применим закон действия масс, выраженный уравнением:
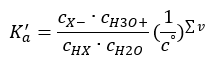
Возможны два способа усечения показанной зависимости. Первый шаг — принять концентрацию воды за константу. Символ co также можно опустить, так как он выражает стандартную концентрацию со значением 1 моль/дм3. Однако важно включить его в исходную формулу и учесть при определении единицы измерения. Это связано с тем, что химические константы являются безразмерными величинами. В отличие от этого, все концентрации, используемые в формуле, имеют единицу моль/дм3. В конечном итоге, таким образом, мы получаем формулу для константы диссоциации:
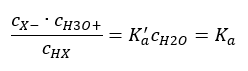
Отношения, выражающие константу диссоциации кислоты (Ka), являются экспериментально определенными величинами в пределах от 10-10 до 108. Обычно формулу используют в логарифмической форме, как отрицательный логарифм константы диссоциации, обозначаемый как pKa:
pKa = -logKa
Важным фактом является то, что если низкие значения Ka соответствуют слабым кислотам, а высокие — сильным, то для pKa все меняется противоположным образом. Малые, обычно отрицательные значения pKa, соответствуют сильным кислотам. Напротив, положительные, большие значения pKa — слабым кислотам. Введя еще одно понятие — степень диссоциации (α), которая обозначает отношение числа молей молекул данного химического соединения, подвергающихся диссоциации (распадающихся на ионы), к общему числу молей этого соединения, присутствующих в рассматриваемом растворе, уравнение можно развить дальше. Пренебрегая очень низкой концентрацией ионов водорода, образующихся при диссоциации воды, и используя равновесные концентрации ионов и молекул, можно предположить, что:
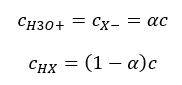
Тогда константу диссоциации можно записать как:

В таком виде это зависимость степени диссоциации электролита от его концентрации, т.е. закон разбавления Оствальда. При рассмотрении очень слабых электролитов степень диссоциации α можно принять равной <<1, и формула упрощается до вида:

В случае кислот, содержащих в своей структуре более одного протона, имеет место многоступенчатая диссоциация, и необходимо рассмотреть все ее стадии. Например, для получения ортофосфорной кислоты существует три стадии:
- H3PO4 + H2O = H2PO4— + H3O+
- H2PO4— + H2O = HPO42- + H3O+
- HPO42- + H2O = PO43- + H3O+
Каждая стадия имеет свою константу равновесия, которую можно расписать аналогично первой стадии:

Константы диссоциации являются стабилизироваными значениями, как для анаэробных, так и для аэробных кислот.
| Кислота | Ka | pKa |
| HF | 6,3·10-4 | 3,2 |
| HCl | 1·107 | -7 |
| HNO3 | 27,54 | -1,44 |
| H3PO4 | 6,9·10-3 | 2,16 |
Таблица 1. Примеры значений константы диссоциации для кислот.
Процесс установления равновесия оснований при диссоциации аналогичен. Если взять пример основания B, то уравнение можно записать в виде:
![]()
Затем, желая вывести константу диссоциации основания, используя закон действия масс и предполагая, что концентрация воды в разбавленном растворе практически постоянна, получаем:

Чем сильнее основание, тем выше константа диссоциации и ниже значение pKb, а чем слабее основание, тем ниже константа диссоциации и выше значение pKb.
| Основание | Kb | pKb |
| Гидразин | 3·10-6 | 5,5 |
| Аммиак | 1,78·10-5 | 4,75 |
| Метиламин | 5,0·10-4 | 3,3 |
Таблица 2. Примеры значений констант диссоциации для оснований.

Факторы, определяющие силу кислот
Зная выражения констант диссоциации конкретных кислот, можно сделать несколько верных предположений:
- Сила анаэробной кислоты возрастает по мере увеличения атомного номера элемента, связанного с атомом водорода.
- Сила анаэробной кислоты падает по мере увеличения электроотрицательности элемента, присоединенного к атому водорода. Это может ввести в заблуждение из-за того, что теоретически увеличение электроотрицательности должно способствовать отщеплению протонов.
- Размер аниона, образующегося во время диссоциации, влияет на константу диссоциации в большей степени, чем электроотрицательность.
Автодиссоциация воды
Интересным случаем диссоциации является процесс расщепления молекул воды. Поскольку они обладают способностью как принимать протоны, так и отдавать их, чистая вода подвергается небольшой степени автодиссоциации согласно уравнению:
H2O + H2O ↔ H3O+ + OH—
Также можно, по аналогии с кислотами и основаниями, применить закон действия масс в отношении равновесных концентраций недиссоциированной воды и ее анионов и катионов:
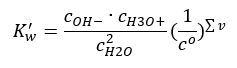
Оказывается, что концентрации катионов H3O+ и анионов OH— настолько малы по сравнению с недиссоциированной водой, что даже их изменение почти не меняет концентрацию недиссоциированной воды. Таким образом, можно принять это значение за константу и преобразовать формулу, сократив ее до вида:
Kw = cOH— · cH3O+
Это особенно важный аспект в контексте химических расчетов, и такая константа называется ионным произведением воды. Он также часто используется как отрицательный логарифм, обозначаемый как pKw. Это равнозначно обозначению -logKw. Из уравнения следует, что если ионное равновесие воды нарушается в результате поступления ионов H3O+, то для поддержания постоянства ионного произведения необходимо снижение концентрации ионов OH—. Аналогично, избыток ионов OH— также приводит к снижению концентрации катионов. Произведение этих концентраций должно оставаться постоянным. Экспериментально было найдено, что Kw при 298 K составляет 10-14. Поэтому правильное уравнение для чистой воды также можно записать в виде:

З диссоциацией связан и pH раствора. Растворы с равными концентрациями катионов H3O+ и анионов OH— обладают нейтральной реакцией. В кислых растворах концентрация катионов выше 10-7моль/л, а в щелочных — ниже 10-7моль/л.