По определению, химическая активность - это способность элемента отдавать электроны в химических реакциях. На практике их активность возрастает по мере уменьшения электроотрицательности - показателя способности элемента притягивать электроны. Если металл притягивает электроны менее сильно, он более реакционноспособен. Эталонный элемент, водород, используется для классификации химической активности металлов. Показателем активности металла является его способность вытеснять водород из кислот или водород из молекулы воды.

Ряд химической активности металлов
Этот термин используется для описания сочетания химических элементов, которые по своей природе являются металлами, в определенном порядке от наименее до наиболее химически активного. Это используется для сравнения активности различных металлов. Помимо металлов, в спектр химических действий входит один неметалл — водород, который является эталонным элементом.
Чем выше в ряду активности находится металл, тем он более реакционноспособен. Это также связано с тем, что он легче окисляется, а значит, является более сильным восстановителем и более химически активным элементом. Напротив, чем ниже в ряду активности находится металл, тем менее он реакционноспособен. Это означает, что он легче вступает в реакцию восстановления и поэтому является более сильным окислителем, менее активным элементом.
Используя значения, приведенные в таблице 1, мы видим, что чем ниже значение стандартного потенциала элемента, тем сильнее восстановитель и тем более химически реактивен металл. Мерой способности к донорству электронов у различных металлов является значение их стандартного потенциала. Для водорода, точнее, для водородного электрода, стандартный потенциал принимается равным нулю. Стандартный потенциал — это электродвижущая сила ячейки, состоящей из стандартной водородной полуячейки и интересующей нас полуячейки, в которой концентрации субстратов и продуктов равны 1 моль/дм3.
| Электрод | Стандартный потенциал [В] |
| Li/Li+ | -3,04 |
| Ca/Ca2+ | -2,86 |
| Mg/Mg3+ | -2,36 |
| Al/Al3+ | -1,69 |
| Mn/Mn2+ | -1,18 |
| Zn/Zn2+ | -0,76 |
| Cr/Cr3+ | -0,74 |
| Fe/Fe2+ | -0,44 |
| Cd/Cd2+ | -0,40 |
| Co/Co2+ | -0,28 |
| Ni/Ni2+ | -0,26 |
| Sn/Sn2+ | -0,14 |
| Pb/Pb2+ | -0,14 |
| Fe/Fe3+ | 0,04 |
| H2/2H+ | 0,00 |
| Bi/Bi3+ | +0,32 |
| Cu/Cu2+ | +0,34 |
| Ag/Ag+ | +0,80 |
| Hg/Hg2+ | +0,85 |
| Au/Au3+ | +1,52 |
Таблица 1. Электрохимический ряд металлов
Металлы, видимые в верхней части ряда, являются наиболее активными. Те, что выше водорода, легко окисляются и поэтому являются более сильными восстановителями, чем он. Элементы, расположенные ниже водорода в ряду, легче восстанавливаются и являются более сильными окислителями. Если металл имеет более отрицательный потенциал, чем другой, это означает, что он будет вытеснять его из соли. Например, железо вытесняет медь в солях меди, но медь не вытесняет железо из своих солей. Вместо этого он может вытеснять серебро из солей серебра. Литий и бериллий из растворов солей других металлов не вытесняют их, а непосредственно реагируют с водой. Они вытесняют водород и образуют свои соединения — гидроксиды. Такие металлы называются активными.
Активность металлов и периодическая таблица элементов
Как и многие другие свойства, химическая активность элемента может быть обусловлена его положением в периодической таблице. Наиболее активными являются металлы групп I и II, так как они легко вытесняют водород из воды, образуя гидроксиды. Химическая активность металлов, как группы, возрастает с увеличением атомного номера. Период уменьшается по мере увеличения атомного номера.

Драгоценные и цветные металлы
Водород не только служит точкой отсчета активности, но и разделяет драгоценные и неблагородные металлы на линии. Цветными металлами называются те, что выше водорода. Каждая из них реагирует с кислотами, вытесняя из них водород. От калия до кальция они реагируют с водой уже при комнатной температуре, а от магния до железа — при повышенных температурах.
Все металлы, которые находятся ниже водорода в ряду активности, не вытесняют водород из кислот. Однако они могут реагировать с окислительными кислотами с образованием соответствующих солей и оксидов, которые образуются при восстановлении кислотного остатка.
Элементы, расположенные в нижней части ряда, от серебра до золота, настолько устойчивы к химическим реакциям, что вступают в реакцию только с королевской водой. Такой раствор представляет собой смесь концентрированного раствора соляной кислоты и концентрированного раствора азотной кислоты (V), смешанных в объемном соотношении 3:1. Зная эти факты, можно сделать вывод, что для определения активности интересующего нас элемента можно провести несколько реакций: с водой комнатной температуры, с горячей водой, с неокислительной кислотой, с окислительной кислотой и с маточной водой.
Эксперимент по обнаружению металлов, вытесняющих водород из кислот
Самый простой способ подтвердить активность металла — провести эксперимент. Для этого необходимо подготовить десять пробирок, в которые последовательно помещаются: в 1-5: магниевая лента, цинковая проволока, железная проволока, никелевая проволока и медная проволока. Тот же порядок повторите в пробирках 6-10. Затем добавьте несколько миллилитров соляной кислоты в пробирки 1-5 и несколько миллилитров разбавленной серной кислоты (VI) в пробирки 6-10. Нанесите зажженную дугу на каждую трубку. В пробирках с магниевыми лентами и железными, цинковыми и никелевыми проволоками, залитыми кислотами, выделяются пузырьки газа. Наиболее интенсивное выделение наблюдается в пробирках, содержащих магний. Происходят следующие реакции:
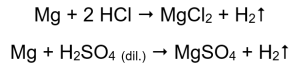
Количество выделяемого газа уменьшается в ряду: цинк, железо, никель. Там происходят соответствующие реакции:

В трубках, содержащих медные провода, газ не виден, никаких изменений. Это означает, что такие реакции не происходят:
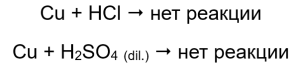
При подаче горящей дуги в трубках, из которых выходит газ, раздается характерный звук.
Резюме наблюдений и выводы:
Магний, цинк, железо и никель реагируют как с соляной, так и с серной кислотой (VI). Каждый из них вытесняет водород из кислоты, что означает, что они находятся выше в ряду активности металлов, чем кислота. В результате реакций образуются продукты в виде солей и выделяется газ — водород.
Характерный звук, сопровождающий прикладывание раскаленной стрелки к пробирке с вытекающим газом, вызван реакцией водорода с кислородом.
Из всех протестированных металлов магний является самым реактивным, за ним следуют цинк, железо, никель и медь. Это можно определить по интенсивности выделения пузырьков газа, которая указывает на активность металла.
В пробирках, содержащих медь, изменений не наблюдалось. Это показывает, что медь не способна вытеснить водород ни из соляной кислоты, ни из разбавленной серной (VI) кислоты.