Электроотрицательность - это величина, отражающая склонность данного атома в молекуле притягивать к себе электроны. А на практике - это способность атома или функциональных групп притягивать электронную плотность друг к другу. Наиболее часто используемая шкала, связанная с этой величиной, - шкала, введенная Лайнусом Полингом, с помощью которой можно легко рассчитать приблизительный характер связи.

Характеристики электроотрицательности
Гомоядерные молекулы, напримерH2 и O2, имеют равные коэффициенты cA и cB на своих молекулярных орбиталях, которые можно записать с помощью волновых функций:
Ψ+AB = cAΨA + cBΨB
Ψ−AB = cAΨA − cBΨB
В этом случае орбиталь характеризуется тем, что ее форма симметрична относительно центра молекулы, а электрический заряд распределен на ней одинаково симметрично. Другой пример — гетероядерные молекулы, в которых практически невозможно сохранить равенство коэффициентов, а также их полную симметрию относительно центра молекулы. Когда уровень энергии атомной орбитали ΨB ниже уровня энергии атомной орбитали ΨA, возникает соотношение , и максимум плотности вероятности встречи электронов смещается в сторону атома B. На практике это приводит к смещению электронной пары, разделяемой в химической связи, т.е. к поляризации в сторону атома B. Например, в молекуле гидрида лития LiH этот сдвиг происходит в сторону атома водорода, а в молекуле фтористого водорода HF — в сторону атома фтора. Это означает, что атом водорода имеет более низкий энергетический уровень, чем литий, но более высокий, чем фтор. В этих условиях один из атомов двух молекул приобретает отрицательный заряд, обозначаемый как -δ, а другой — положительный +δ. Общая формула такой молекулы — A+δB-δ.
Заряды атомов
Вышеупомянутый заряд δ может принимать различные значения в зависимости от элементов, связанных химической связью. Значение 0 означает, что электронная пара распределяет свой заряд симметрично и полностью располагается вблизи атома с более низким энергетическим уровнем, в результате чего оба электрона передаются этому атому. Это создает ионную связь между элементами. В подавляющем большинстве химических связей, однако, присутствуют дробные заряды, в результате чего они стоят между ковалентными и ионными связями.
Дипольный момент
Диполь — это молекула, в которой можно выделить два полюса — положительный и отрицательный. Дипольный момент, обозначаемый μ, с другой стороны, является мерой величины смещения электрического заряда в нем. Она определяется как произведение абсолютной величины электрического заряда (δ), заключенного в одном из полюсов, и расстояния до этих полюсов (l):
μ = δ — l
Мы называем положительный заряд (δ+) и отрицательный заряд (δ-) частичным зарядом и приписываем его расположение конкретному атому, но на самом деле это лишь большая или меньшая вероятность нахождения электрона вокруг его ядра. Такое явление иногда путают с процессами окисления и восстановления, но в отличие от происходящих при этом изменений, принятие атомами таких зарядов не приводит к их переходу в другое состояние окисления, поэтому обмена электронами между ними не происходит. Единицей СИ для выражения дипольного момента является кулонометр (C-m). Однако в расчетах чаще всего используется его единица, записанная в системе СГС, — дебай (D). Один дебай соответствует значению 3,33564-10-30 С-м. Наибольший теоретически возможный дипольный момент характерен для молекул с чисто ионной связью. Напротив, наименьший возникает в молекулах, связь которых чисто ковалентная — дипольный момент в этом случае равен нулю. Однако большинство из них являются промежуточными случаями с различными характерами частиц.
Дипольный момент галогеноводородов
Несколько взаимосвязей между электроотрицательностью и дипольным моментом можно легко проследить на примере конкретных химических соединений.
Таблица 1 Дипольные моменты галогеноводородов
| Связь | Экспериментально определенный дипольный момент [μ, D] | Длина связи [пм] | Произведение элементарного заряда и дипольной длины [e-l, D] | Доля ионного характера [%] | Разница в электроотрицательности фтора и водорода |
| HF | 1,98 | 92 | 4,42 | 45 | 1,9 |
| HCl | 1,08 | 128 | 6,15 | 18 | 0,9 |
| HBr | 0,79 | 143 | 6,87 | 12 | 0,7 |
| HI | 0,38 | 162 | 7,78 | 5 | 0,4 |
Отношение μ/(e-l’), то есть отношение фактического дипольного момента к дипольному моменту, соответствующему ионной связи, может служить мерой отклонения от полностью ковалентной природы связи. Произведение этой зависимости в виде (μ/(e-l’))-100% представляет собой процент ионного характера в рассматриваемой связи. Это лишь приблизительное значение, поскольку дипольный момент зависит не только от полярности связи, но и от поведения пар свободных электронов. Случается, что электронное облако может быть смещено к внешней стороне молекулы, вследствие чего в уравнении для определения ее дипольного момента появляется дополнительный член. В случае молекулы аммиака облако направлено в соответствии с дипольным моментом связи, что приводит к увеличению результирующего дипольного момента. Напротив, для молекулы монооксида углерода облако направлено в противоположную сторону и, следовательно, уменьшает результирующий дипольный момент.

Электроотрицательность
Это безразмерная эмпирическая величина, отражающая склонность данного атома в молекуле притягивать к себе электроны. А на практике — это способность атома или функциональных групп притягивать электронную плотность друг к другу. Наиболее часто используемая шкала, связанная с этой величиной, — шкала, введенная Лайнусом Полингом, с помощью которой можно легко рассчитать приблизительный характер связи. Ученый использовал следующий метод для расчета электроотрицательности отдельных элементов:
Мы предполагаем, чтоDA-A иDB-B — это энергии связей двухатомных молекул(A2, B2). Энергию связи, возникающую в молекуле, мы обозначаем какDA-B. Эмпирически было показано, что если такая связь содержит мало или совсем не содержит ионного характера, то разница между значениямиDA-B и средним геометрическим значением энергийDA-A иDB-B равна или близка к нулю. Когда связь A-B имеет явные отклонения от ковалентного характера, эта разница принимает положительные значения, которые увеличиваются по мере увеличения доли ионного характера. Разница между электроотрицательностями (x) двух атомов, участвующих в связи, выражается формулой:
![]()
Следовательно, если в своих расчетах Полинг принял электроотрицательность фтора равной 4,0, то можно рассчитать последующие электроотрицательности элементов. Если нам известно значение xA атомов элемента A и значение коэффициента Δ’, то мы можем вычислить значение xB, используя приведенное выше уравнение. Шкала Паулинга построена таким образом, что ее значения приблизительно совпадают со значениями дипольного момента связи, образованной рассматриваемыми атомами, как видно из примера в таблице 1, где приведены значения, определенные для галогеноводородов. Помимо описанной выше шкалы, в научной литературе описано еще несколько, в том числе электроотрицательность, описанная:
- Малликеном, в работах которого предполагалось, что электроотрицательность элемента прямо пропорциональна сумме его электронного сродства и энергии ионизации. Сродство к электрону — это количество энергии, которое выделяется при присоединении электрона к нейтральному атому, и энергия ионизации, равная количеству энергии, необходимой для отрыва электрона от нейтрального атома. Поэтому наибольшей электроотрицательностью характеризуются атомы, обладающие высоким сродством к электрону и высокой энергией ионизации.
- Оллред и Рохов, которые предположили пропорциональность электроотрицательности мере силы, с которой атомное ядро (Z) действует на валентные электроны, записанной в виде
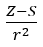 (r — атомный радиус, S — постоянная экрана). Согласно их теории, электроотрицательность (x) элементов можно рассчитать по формуле:
(r — атомный радиус, S — постоянная экрана). Согласно их теории, электроотрицательность (x) элементов можно рассчитать по формуле:
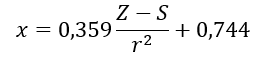
На каждой шкале электроотрицательность водорода близка к значению 2,2, а другие значения незначительно варьируются. Примеры электроотрицательностей атомов элементов, рассчитанных по шкалам Полинга, Малликена, Оллреда и Рохова, приведены в таблице 2 ниже.
Таблица 2 Электроотрицательность элементов-образцов по шкалам Полинга (P), Малликена (M) и Оллреда и Рохова (AR)
| Атом | P | M | AR |
| F | 3,98 | 3,90 | 4,10 |
| O | 3,44 | 3,04 | 3,50 |
| N | 3,04 | 2,28 | 3,07 |
| Cl | 3,16 | 2,95 | 2,83 |
| C | 2,55 | 1,75 | 2,50 |
| H | 2,20 | 2,21 | 2,20 |
| Si | 1,90 | 2,25 | 1,74 |
| K | 0,82 | 0,77 | 0,91 |
| Rb | 0,82 | 0,50 | 0,89 |
| Cs | 0,79 | — | 0,86 |
| Fr | 0,70 | — | 0,86 |
Несмотря на расхождения в расчетах трех методов, фтор имеет самую высокую электроотрицательность на каждой шкале, за ним следуют кислород, азот и хлор. Наименьшие значения были определены для франция, цезия, рубидия и калия. Элементы, которые обычно являются неметаллами, имеют электроотрицательность выше значения 2, а типичные металлы имеют электроотрицательность ниже 2. Стандартным значением является вышеупомянутая электроотрицательность водорода, равная примерно 2,2.

Электроотрицательность в периодической таблице
Как и многие другие свойства, электроотрицательность отражается и на расположении химических элементов в периодической таблице. В группе электроотрицательность уменьшается с увеличением количества покрытий и металлического характера, поэтому она увеличивается в направлении от франция к водороду. В течение периода электроотрицательность возрастает с увеличением числа присутствующих валентных электронов и уменьшением неметаллического характера, так от металлов к благородным газам.
Электроотрицательность и тип связи — краткое содержание
Зная индивидуальные значения электроотрицательности элементов, образующих химическую связь, можно сделать вывод о ее природе. Если их разница составляет от 0,0 до 0,4, связь ковалентная. Когда эта разница составляет от 0,4 до 1,7, связь является поляризованной ковалентной. При значении разницы в электроотрицательности элементов, равном 1,7, можно ожидать возникновения ионной связи.