В химии некоторые химические соединения образуют особые связи с молекулами воды. Это не химические связи, а короткодействующие взаимодействия, которые определяют свойства этих соединений. Это также гидраты. Их свойства находят широкое применение в отдельных отраслях промышленности. Самой популярной гидратированной солью, несомненно, является гипс, или дигидрат сульфата кальция, который является важным сырьем в строительной промышленности. Гидраты также являются очень хорошими индикаторами содержания влаги. Это связано с тем, что цвет безводной соли часто отличается от цвета гидратированной соли.

Гидраты
Гидраты не являются химическими соединениями, в которых между молекулами воды и молекулами выбранной соли возникают химические связи, например, ковалентные. Они также не являются координационными соединениями. Для этих структур характерно образование водородных связей, которые гораздо слабее по прочности, чем химические. Гидраты имеют структуру в виде кристаллической решетки. Молекулы воды распределены в нем неравномерно. Часто встречается термин «кристаллизационная вода».
Гидраты получают путем гидратации. Молекулы солей, особенно производных неорганических кислот, чаще всего подвергаются этой реакции. Гидратация — это превращение безводных кристаллов в гидратированные. Он может вызвать изменения в минеральной массе, но не разрушает ее. Гидратация часто сопровождает другие процессы, например, карбонизацию. Гидратационные химикаты при нормальных условиях характеризуются высокой гигроскопичностью, то есть сильным сродством к молекулам воды. Такие вещества способны, например, поглощать влагу из воздуха. Другой способ получения гидратов — кристаллизация из водных растворов.
Суммарные формулы гидратов составляются путем записи формулы соли и указания количества гидратированных молекул воды. Для общего обозначения перед«H2O» ставится буква «n». Он принимает значения больше единицы и соответствует количеству присоединенных молекул воды. Чаще всего различают гидраты с n=½ (гемигидрат), n=1 (моногидрат), n=2 (дигидрат) и n=3 (тригидрат). Важно отметить, что одно и то же вещество может присоединять разное количество молекул воды.
![]()
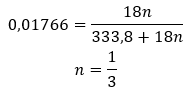
Учитывая наличие водородных связей между молекулами соли и молекулами воды, эти соединения не демонстрируют удовлетворительной устойчивости к повышенным температурам. При нагревании они распадаются и переходят в безводную форму. Гидраты очень хорошо растворяются в воде. В водных растворах гидратированные молекулы воды, прикрепленные к соли, высвобождаются. Этот факт следует учитывать, например, при изготовлении растворов этих веществ. Если не учитывать степень гидратации того или иного соединения, это приводит к ошибкам, хотя бы при определении концентрации раствора. Важной характеристикой гидратированных солей является изменение их цвета, обусловленное присоединением молекул воды в ходе реакции гидратации. Следует отметить, что гидратированные формы проявляют значительно меньшую гигроскопичность по сравнению с безводными солями.
Гидраты неорганических соединений
Соли неорганических кислот — это вещества, которые с наибольшей вероятностью образуют гидраты с молекулами воды. К наиболее распространенным гидратам неорганических соединений относятся:
- Гидрат сульфата меди (II), CuSO4 — гидрат сульфата меди (II) принимает различные степени гидратации. Максимальное количество присоединенных молекул воды — пять. В результате нагревания пентагидрата этой соли происходит отрыв молекул воды. Сначала образуются два и тригидрат, а при дальнейшем нагревании системы можно получить моногидрат сульфата меди (II). Чтобы удалить последнюю молекулу воды, необходимо нагреть соединение до температуры более 200 ᵒC. Гидраты сульфата меди (II) приобретают синий цвет, что обусловлено наличием кристаллизационной воды вокруг ионов меди. Безводная соль, напротив, имеет белый цвет. Его высокая гигроскопичность и способность образовывать гидраты используются для удаления влаги из некоторых жидкостей.
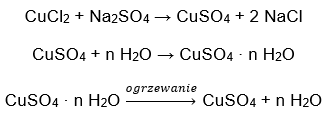
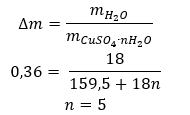
- Гидрат хлорида кобальта (II),CoCl2 — безводный хлорид кобальта (II) обладает высокой гигроскопичностью. Благодаря сильному сродству к молекулам воды он способен поглощать влагу даже из воздуха. В результате этого процесса образуются гидраты этой соли. Наиболее распространенной гидратированной формой является гексагидрат хлорида кобальта (II) — CoCl2 * 6H2O. Другая форма — молекула дигидрата. Эта соль также обладает способностью менять цвет в зависимости от содержания влаги. Безводная соль имеет синий цвет, дигидрат приобретает розовато-фиолетовый оттенок, а молекула гексагидрата — насыщенный красный цвет.
- Гидрат сульфата натрия, Na2SO4 — эта соль существует в виде двух гидратов: гептагидрата (пять молекул воды в структуре) и декагидрата (десять молекул воды в структуре). Безводная форма сульфата натрия встречается в природе в виде редкого минерала тенардита. Десятиводный сульфат натрия — это так называемая глауберова соль. Он широко используется в производстве стекла, бумаги, стирального порошка и соды. Глауберова соль также является одним из ингредиентов, необходимых для производства синего пигмента ультрамарина. Кроме того, соединение оказывает терапевтическое воздействие на пищеварительную систему, благодаря своему слабительному действию.

Гипс
Примером гидрата неорганической соли, имеющего глобальное значение и широкое применение, является гипс. Это минерал, состоящий из гидратированной формы сульфата кальция, CaSO4. Кристаллический гипс является дигидратом этой соли. В природных условиях он образуется при испарении соленой воды из озер и рек, при температуре ниже 42ᵒC. Безводный сульфат кальция — это ангидрит. Его также называют безводным гипсом. Строительный гипс, с другой стороны, представляет собой гемигидрат сульфата кальция. Какая форма этой соли получается, зависит от температуры, преобладающей при обработке материнской осадочной породы. Гипс, используемый в строительстве, обычно представляет собой смесь различных видов гашеной известковой соли.
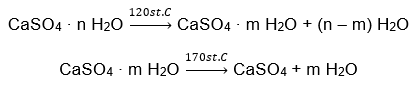
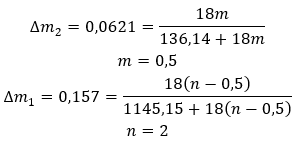
Возможности применения гипса очень широки, особенно в строительной отрасли. Ниже перечислены наиболее важные области применения этого гидрата соли:
- В строительной индустрии гипс используется в отделочных элементах. Это один из компонентов сыпучих промежуточных продуктов, строительных растворов, клеев, гипсовых смесей и готовых монтажных компонентов, например, гипсокартона.
- В медицине используется гипс для фиксации сломанных конечностей. Гипсовые повязки считаются безопасными для кожи. Кроме того, этот материал используется в лабораториях стоматологической техники.
- В промышленности гипс используется в мастерских по моделированию и дизайну. Гипсовые слепки очень удобны для формирования различных утилитарных предметов.
- Гипс является добавкой к некоторым удобрениям, используемым в сельском хозяйстве.

Клатраты метана
Клатраты метана относятся к группе соединений, известных как газогидраты. Они ответственны за большинство быстрых изменений климата в истории Земли. Клатраты метана также часто называют гидратами метана, метановыми гидратами или метановым льдом. Они образуют твердую форму из воды и метана. Их молекулы отличаются кристаллической структурой. Они образуются под воздействием повышенного давления. Они имеют вид белых твердых частиц без запаха, которые по внешнему виду часто сравнивают со льдом. Интересно, что на ощупь они напоминают полистирол. Клатраты — это уникальные химические группы. Молекулы воды образуют структуру, напоминающую клетку. Внутри этой клетки хранится метан. Важно отметить, что эти два вещества не образуют друг с другом химических связей. Как правило, клатраты метана состоят из 46 молекул воды, окружающих две малые и шесть средних клеток. Внутри них заперты молекулы метана. Известно, что клатраты состоят из 136 молекул воды, внутри которых находятся 16 маленьких и восемь больших клеток с газообразным метаном.
В последние годы на дне океанов были обнаружены значительные запасы этого ресурса. Оно вызывает большой интерес из-за возможности добычи значительного количества метана, который можно использовать, например, в энергетических целях. Клатраты метана горят ровным пламенем красноватого цвета. После горения остается талая вода. Добытый таким образом метан может стать хорошей альтернативой традиционным источникам углеводородов, но он также представляет собой немалую угрозу для климата. О добыче метана из клатратов, скопившихся на дне океана, известно пока недостаточно. Неконтролируемый выброс значительных количеств этого газа может быть очень опасен, так как он усиливает парниковый эффект гораздо сильнее, чем углекислый газ.