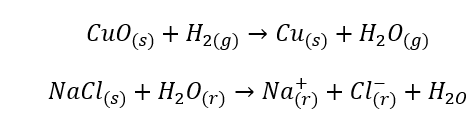Рассмотрение явлений и процессов должно быть многослойным. Следует учитывать свойства как микроскопической, так и макроскопической природы. Как видно из самих названий, это деление осуществляется путем деления порядков анализируемых элементов. Макроскопическая область, тесно связанная с термодинамикой химических реакций, позволяет наблюдать и измерять физические и химические свойства, такие как, например, плотность, температура или растворимость. В случае микроскопического анализа можно наблюдать движения молекул и их взаимодействие. Мы можем описать молекулы с точки зрения их скорости и кинетической энергии. Если областью нашего интереса является смесь, мы должны учитывать ее однородность и, следовательно, тип системы, в которой она представлена.

Классификация физико-химических систем
При рассмотрении однородности материальных систем в макроскопическом масштабе происходит разделение на две основные группы — гетерогенные и гомогенные системы. Это разделение по категориям в соответствии с их физическими свойствами — физическим состоянием, растворимостью, температурой плавления, которые различаются или нет. Каждая система состоит из всех веществ, участвующих в реакции или процессе. Четко различимая часть системы, характеризующаяся сохранением тех же свойств, называется фазой. Различают три основных типа фаз — твердое тело, жидкость и газ. Поверхность между ними и остальной частью системы является фазовой границей. В зависимости от энтропии (ΔS) или свободной энтальпии (ΔG), если ΔS>0 или ΔG<0, переход фаз из одной в другую может происходить самопроизвольно.
Фазовая диаграмма
Фазовая диаграмма представляет собой графическое представление возникновения различных фаз. Она учитывает возникновение данных фаз в случае достижения определенных диапазонов температуры и давления, а также их взаимные изменения. Схематическая фазовая диаграмма для односоставляющей системы иллюстрирует наличие трех основных фаз в зависимости от условий выполнения процесса. Линии на ней обозначают состояния равновесия между соответствующими двумя фазами, т. е. между твердым телом и газом, между твердым телом и жидкостью, между газом и жидкостью. Зная один из критических параметров, можно определить условия, при которых будет происходить плавление, затвердевание, испарение, конденсация, сублимация и ресублимация описываемой составляющей. Кроме того, на графике есть тройная точка, где сходятся все фазовые линии, что означает возможность одновременного сосуществования трех фаз при определенных условиях. Диаграмма также содержит два очень важных момента — критическое давление и критическую температур. Критическое давление определяет точку, отражающую максимальное давление, при котором жидкость может превратиться в газ, или максимально возможное давление насыщенного пара над жидкостью. С другой стороны, понятие критической температуры определяет самую высокую температуру, при которой газ может конденсироваться при повышении давления. Следовательно, критическая точка, находящаяся в условиях критической температуры и критического давления, описывает состояние, в котором жидкую и газовую фазы невозможно различить.
Правило фаз Гиббса
Это специфическое отношение, применимое к каждой системе, находящейся в термодинамическом равновесии. Уравнение, определяющее это правило, включает число фаз (f), присутствующих в системе, с числом независимых составляющих (n) и числом степеней свободы (s). Число s соответствует количеству регулируемых интенсивных переменных, изменение которых не приведет к нарушению числа фаз в равновесии изолированной системы. Интенсивными переменными являются все физические величины, никак не зависящие от системы, например геометрические размеры и объем, а также число молекул в системе, ее масса, удельная теплоемкость и тому подобное. Уравнение принимает следующий вид:
Независимые составляющие системы, отмеченные буквой n, на практике означают наименьшее число составляющих рассматриваемой системы, которое необходимо для построения какой-либо ее фазы в любом количестве. Если рассматривать систему, составляющие которой могут вступать в реакцию друг с другом, то расчет числа n производится путем вычитания числа независимых уравнений реакции из общего числа составляющих, образующих данную систему. То есть, если для реакции, принимающей вид:
![]()
число независимых уравнений составляет 1, мы рассматриваем конкретную реакцию, протекающую в системе. Самостоятельным уравнением называется любая система химических уравнений, в которой невозможно получить ни одно из них, комбинируя остальные. Хотя число составляющих для этой системы равно 3, присутствуют CaCO3, CaO и CO2. Благодаря этой информации также можно рассчитать число независимых составляющих:
n = число составляющих — число независимых уравнений, поэтому:
n = 3 – 1 = 2
На том же примере также можно рассчитать количество степеней свободы, используя уравнение для правила фаз Гиббса:
s = n – f + 2 = 2 – 3 + 2 = 1
Это значение означает, что для поддержания стабильности количества числа фаз в равновесии системы можно оперировать только одной интенсивной переменной.

Гетерогенная система
Любая система, в которой имеется более одной фазы и, следовательно, неоднородная система, также является гетерогенной. Неважно, какие это фазы — гетерогенная система может содержать одновременно несколько твердых и жидких фаз, но только одну газовую фазу. Это происходит потому, что газы идеально смешиваются.
Интересным примером гетерогенной системы является гранит — в нем много твердых фаз, в том числе кварц, калиевый полевой шпат, плагиоклаз и биотит. Многие продукты также можно назвать гетерогенными — идеальными примерами являются многосоставляющие мюсли или салатные заправки из жира, специй и других добавок.
Интересным типом неоднородных смесей являются коллоиды, т. е. растворы, в которых необходимо различать составляющие с помощью микроскопа. Однако в большинстве случаев их можно разделить простыми методами или с помощью простых инструментов. Например, чтобы разделить смесь, состоящую из воды и масла, можно использовать декантацию — составляющие видны невооруженным глазом. К другим методам, эффективным для разделения неоднородных смесей, относятся: фильтрация, механическое разделение и центрифугирование. То же самое касается смеси минералов, отличающихся по свойствам — кварц, слюду и полевой шпат можно разделить даже молотком.
Гомогенная система
В отличие от гетерогенной системы гомогенная система характеризуется содержанием только одной фазы — она является однородной. В этом случае не возможно отличить составляющие в системе невооруженным глазом. Кроме того, простые методы разделения неэффективны, и могут быть полезны только методы, основанные на физических свойствах. Примером такого метода является разделение путем перегонки, основанное на различных значениях температуры кипения данной системы. Другими методами, эффективными для разделения однородных смесей, являются кристаллизация и хроматография. Особый тип гомогенной системы представляет собой чистое вещество, единственная фаза которого содержит только одну составляющую. Другой случай — всевозможные однородные растворы и смеси — несмотря на одну фазу, система может содержать множество составляющих. В связи с тем, что фаза, присутствующая в системе, может быть как жидкостью, так и твердым телом или газом, такие формы могут принимать и растворы. Примерами таких систем являются жидкие смеси — уксус, вода, газовые смеси — атмосферный воздух, а также смеси твердых тел, в том числе минеральные руды и всевозможные сплавы, например бронза или латунь.
Изменения в системах
В системах могут происходить два типа превращений — фазовые, реже называемые физическими, и химические. К первым относятся все изменения, которые не приводят к появлению новых химических веществ. Для них также не характерно исчезновение уже присутствующих составляющих. Однако, как следует из названия, они приводят к таким изменениям с точки зрения агрегатного состояния или структуры. Также возможно образование новой фазы с одновременным исчезновением исходной фазы. Примерами фазовых превращений являются ресублимационные и полиморфные превращения элементов. Химические превращения имеют совершенно иной механизм. Это реакции, в результате которых вместо них образуются исходные составляющие, новые вещества. Такие превращения могут происходить в двух вариантах — например, при гидролизе в одной или нескольких фазах и при горении.
Химические реакции
- Гомогенные реакции, также известные как однородные, происходят, когда вся система, включая субстраты и продукты, находится в одной фазе, например:
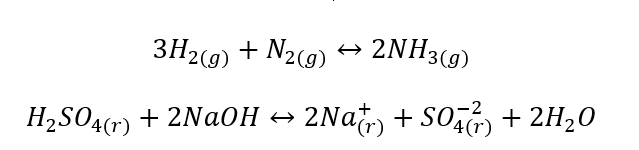
- Гетерогенные реакции — это неоднородные реакции, при которых система, включая субстраты и продукты, находится по меньшей мере в двух различных фазах. Такие реакции всегда происходят на границе разделения фаз, например: