Раствором называется однородная смесь как минимум двух веществ. Хотя раствор ассоциируется главным образом с жидкостями, растворами также называются газообразные и твердые смеси. Тем не менее, очень большая часть химических реакций как в лабораторных, так и в промышленных масштабах происходит в водной среде. Мы можем иметь дело с тремя типами жидких растворов — растворитель всегда жидкий, однако растворенное вещество может быть газом, жидкостью или твердым веществом. Например, это водные растворы хлористого водорода, этанола и соли.

Выражение состава раствора
Самыми важными характеристиками любого раствора являются его состав и концентрация. Умение определять состав раствора и переводить его в интересующие единицы измерения является необходимым навыком для любого химика. Существует несколько методов определения количества данного компонента в смеси, таких как измерение массы, объема или молярности. По этой причине существует несколько типов концентраций, которые зависят от количества компонента в растворе или смеси. При описании составов растворов чаще всего применяются термины: массовая доля, объемная доля, молярная доля, а также молярная концентрация. Доли позволяют определить, какую часть в данной смеси составляет интересующий компонент. Они могут быть выражены в единицах массы, объема или молях соединения.
Молярная концентрация
Является наиболее часто выбираемой концентрацией из-за удобства оперирования ею на основе определения количества молей вещества, содержащегося в объеме раствора. Теоретической основой является утверждение, что растворы двух различных веществ, имеющие одинаковую концентрацию и объем, находясь при одинаковой температуре, содержат одинаковое число молей и, следовательно, одинаковое число молекул растворенного вещества. Благодаря этой взаимосвязи, для растворов одинаковой молярной концентрации, чтобы добиться правильного соотношения количества молей, определяемого стехиометрическими коэффициентами, можно смешивать соответствующие объемы растворов. Это означает, что при рассмотрении реакции типа A + B → C, где один моль вещества A реагирует с одним молем вещества B, то для полного протекания реакции необходимо смешать равные объемы обоих растворов одинаковой молярной концентрации. В случае реакции типа A + 2B → C, то есть один моль вещества A реагирует с двумя молями вещества B, необходимо смешать один объем раствора A с двумя объемами раствора B. В этом случае имеется и другое решение, поскольку вместо применения равномолярных растворов в объемном соотношении 1:2 можно применить один объем раствора A и один объем раствора B с вдвое большей концентрацией. Молярная концентрация, обозначаемая символом Cм, показывает число молей вещества, содержащихся в единице объема, чаще всего в 1 дм3 раствора.
Формула для расчета молярной концентрации представляет собой отношение количества молей вещества (nв) к общему объему раствора (Vр), выраженному в дм3:
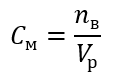
При использовании основной единицы объема по системе СИ, т. е. кубического метра, единица количества вещества должна быть выражена в киломолях. Однако это не создает серьезных проблем при расчетах, поскольку 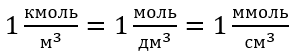 .
.
Единицей молярной концентрации Cм является моль на кубический дециметр, который для простоты часто записывается символом M.
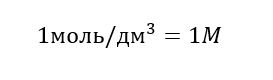

Применение молярной концентрации
a) Вычисление молярной концентрации по содержанию компонента в растворе
Пример 1 Раствор содержит 30 г гидроксида калия в 3,0 дм3 раствора. Вычислите его молярную концентрацию.
Шаг 1 Вычисление молярной массы KOH
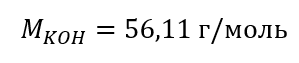
Шаг 2 Вычисление количества молей KOH, присутствующих в растворе.
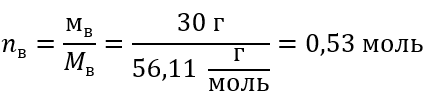
Шаг 3 Вычисление молярной концентрации по формуле
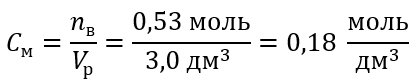
Ответ: Раствор гидроксида калия, содержащий 30 г вещества в 3,0 дм3 раствора, имеет молярную концентрацию
![]()
b) Приготовление раствора заданной концентрации
Пример 2 Вычислите массу глюкозы с формулой C6H12O6, необходимую для приготовления 300 см3 с концентрацией 0,32 .
Шаг 1 Вычисление молярной массы глюкозы
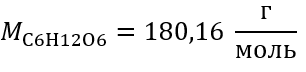
Шаг 2 Вычисление необходимой массы глюкозы по преобразованной формуле молярной концентрации, зная, что 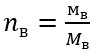 :
:
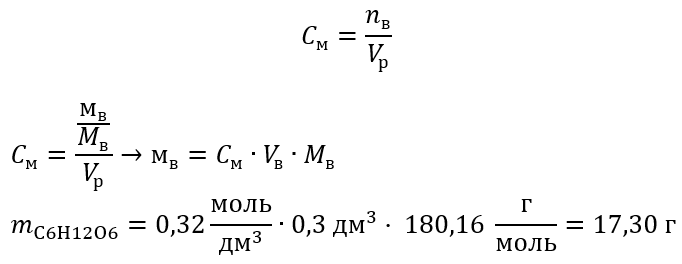
Благодаря вычислениям известно, что для приготовления такого раствора необходимо взвесить 17,30 г глюкозы и количественно их перенести в мерную колбу емкостью 300 см3.
Ответ: Для приготовления 300 см3 раствора глюкозы с молярной концентрацией
0,32 необходимо взвесить 17,30 г вещества.
c) Разбавление и концентрирование концентрированных растворов
Применяя молярную концентрацию, также можно получить раствор заданной концентрации (Cм2) путем разбавления концентрированного раствора (Cм1), где:
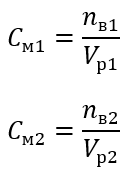
При разбавлении меняется только объем раствора, количество же молей растворенного вещества остается прежним. Поэтому можно предположить, что:
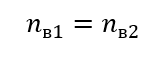
Преобразуя формулу молярной концентрации, получим соотношения:
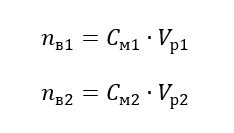
Зная, что , получаем уравнение:
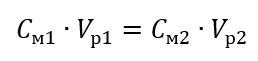
Поэтому формулу для разбавления растворов с учетом молярной концентрации, включая вновь полученную (Cмx), можно записать как:
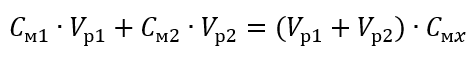
Пример 3 Какой объем 0,150 моль/дм3 кислоты можно получить, разбавив водой 250 см3 0,750 моль/дм3 раствора этой кислоты?
Шаг 1 Преобразование формулы, если предположить, что концентрация воды Cм2 = 0 моль/дм3.
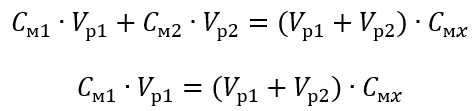
Шаг 2 Вычисление полного объема (Vx)
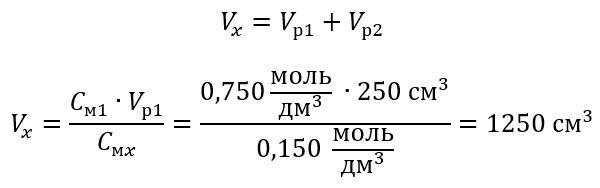
В качестве альтернативы можно применить зависимость постоянства числа молей при разбавлении:
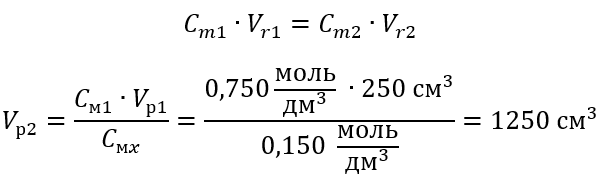
Ответ: Для разбавления кислоты до требуемой концентрации необходимо применить 1,25 дм3 воды.
Пример 4 Вычислите, сколько воды нужно выпарить из 300 см3 раствора с концентрацией 0,125 моль/дм3,чтобы получить раствор с концентрацией 1,50 моль/дм3.
Шаг 1 Преобразование формулы для изменения молярной концентрации, если предположить, что молярная концентрация воды Cм2 = 0 моль/дм3.
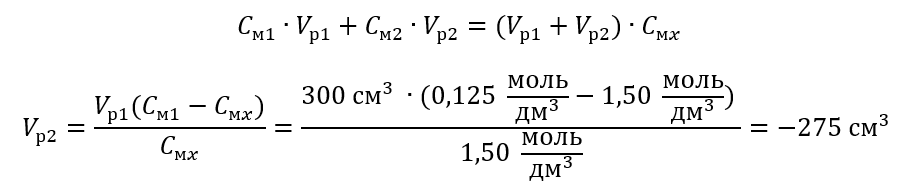
Ответ. Для концентрирования раствора необходимо выпарить 275
Преобразование молярной концентрации в процентную концентрацию
В повседневной лабораторной работе необходимо преобразовывать различные концентрации растворов. Чаще же всего применяется молярная и процентная концентрации. Переходить с одной на другую можно с помощью плотности раствора. Необходимо ввести ее в формулы для интересующих концентраций:
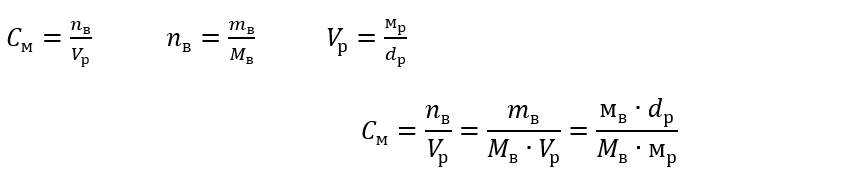
В преобразовании видно отношение массы вещества к массе раствора, которое лежит в основе процентной концентрации, выражаемой формулой:
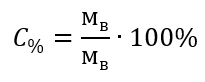
Подставив формулу для процентной концентрации в формулу для молярной концентрации, которая была преобразована ранее, получим зависимость, благодаря которой можно свободно переходить с одной на другую:
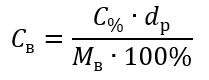
Единственным ограничением формулы является использование соответствующих единиц измерения, поэтому стоит каждый раз учитывать их при вычислении.
Пример 5 Вычислите молярную концентрацию серной кислоты (VI), зная, что ее процентная концентрация C% = 98,0%, а плотность d = 1,84 кг/дм3.
Задача может быть решена двумя способами:
Способ 1. В несколько этапов, без применения формулы
Шаг 1 Вычисление массы 1,00 дм3 кислоты
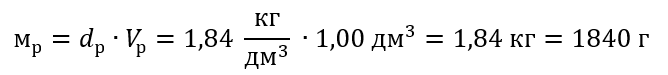
Шаг 2 Вычисление массы кислоты с учетом процентной концентрации
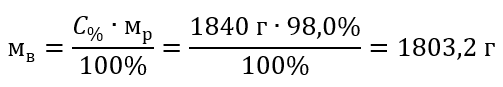
Шаг 3 Вычисление количества молей
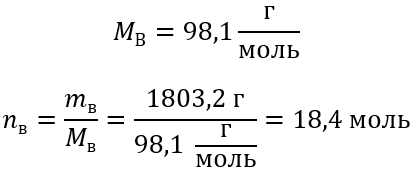
Шаг 4 Вычисление молярной концентрации, зная, что она является количеством молей вещества в 1 дм3 раствора.
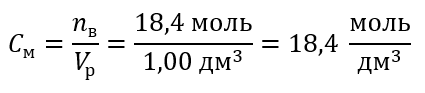
Способ 2. Применение зависимости между процентной и молярной концентрацией
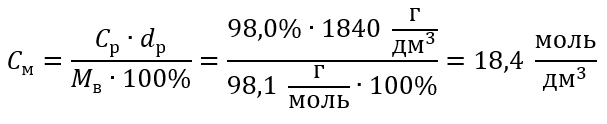
Ответ: Молярная концентрация этой кислоты равна 18,4 моль/дм3.