Химические реактивы, рН-реактивы, качественный анализ, количественный анализ – это лишь некоторые понятия, относящиеся к аналитической химии. Какие тайны еще скрывает эта область химии? Вы найдете информацию в этом разделе!
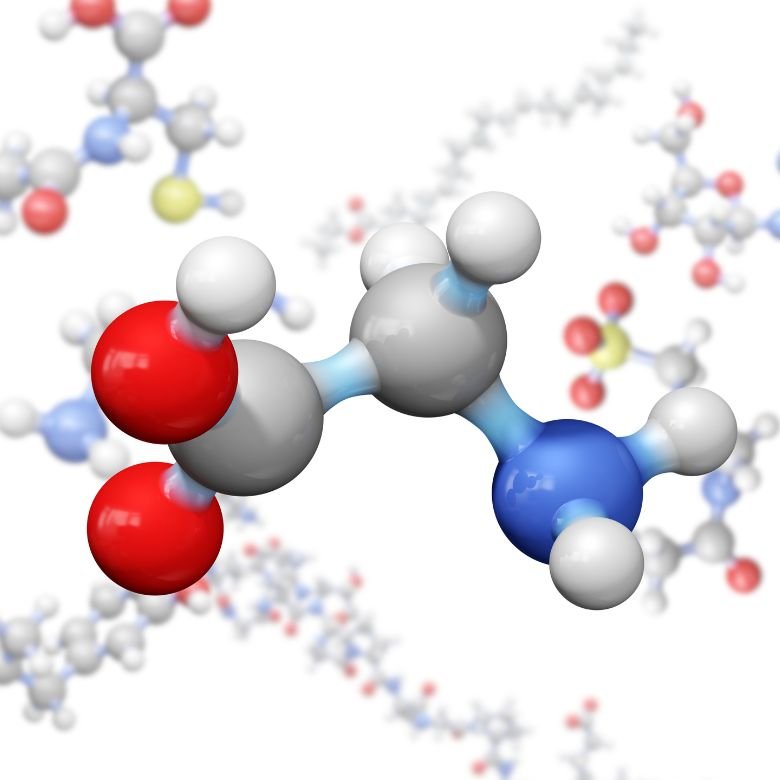
Пептидная связь является одной из самых важных связей, встречающихся в мире природы. Она соединяет отдельные молекулы аминокислот с образованием пептидных и белковых структур. Кроме того, проявляет уникальные свойства благодаря наличию мезомерных форм или возможности вращения функциональных групп вокруг связи углерод-азот.
Пептидные связи (-CO-NH-) являются одними из самых важных связей в природе. По своей структуре они содержат атомы углерода, кислорода, азота и водорода. Эти связи образуются в результате реакции конденсации между карбоксильной группой (-COOH) и аминогруппой (-NH2). Эта реакция чаще всего происходит между двумя разными или одинаковыми аминокислотами. Побочным продуктом является молекула воды. Пептидная связь разрушается при гидролизе. Наблюдается реакция разрыва одной из связей в пептидной группе, восстановлению подлежат отдельные аминокислоты. Реакция гидролиза протекает при повышенной температуре, в водной среде, а также в присутствии концентрированных неорганических кислот или концентрированных оснований.
Пептидные связи представляют собой плоские связи из-за невозможности вращения связи между углеродом карбонильной группы и атомом азота. Однако эта связь имеет мезомерный характер, т. е. существуют две мезомерные формы, которые являются результатом „перемещения" двойной связи в пептидной связи. В результате этого, связь «углерод – азот» частично проявляет природу двойной связи, что усиливает ее химическую стабильность. Пептидные связи встречаются в двух изомерных формах: цис и транс (пептидные связи в белках и пептидах чаще принимают транс-форму).
В зависимости от того, сколько молекул аминокислот соединено между собой пептидными связями, различают:
Объединение более двух молекул аминокислот друг с другом приводит к образованию полипептидов. Две молекулы аминокислот, соединяясь друг с другом, образуют пептидную связь. Уже соединенные аминокислоты имеют свободные функциональные группы, которые могут образовывать дополнительные связи с молекулами других аминокислот. Так образуются полипептиды.
Биуретовая реакция является характерной реакцией, которая позволяет обнаруживать пептидные связи. С ее помощью возможно не только обнаружение пептидных связей, но и их количественное определение. Это особенно полезно в случае химических соединений, в которых пептидные связи находятся в непосредственной близости друг от друга. К таким соединениям относятся, например, пептиды или белки. В биуретовой реакции возможно обнаружение по крайней мере двух пептидных связей. Поэтому этот метод не подходит для обнаружения аминокислот (у них нет пептидной связи) или дипептидов (у них только одна пептидная связь).
Для обнаружения пептидных связей прежде всего создают щелочную реакционную среду, добавляя раствор сильного основания (это может быть гидроксид натрия или гидроксид калия). Это обеспечивает образование окрашенного комплекса ионов меди (II). Затем в исследуемый раствор добавляют сульфат меди (II) интенсивного синего цвета и калий-натрий виннокислый (он отвечает за поддержание соответствующей растворимости всего комплекса). Пептидные связи с ионами меди (II) образуют окрашенный комплекс, который можно анализировать спектрофотометрически при длине волны 546 нм (максимальное поглощение). Изменение цвета с синего на фиолетовый свидетельствует о наличии этой связи в исследуемом материале. Интенсивность окраски, с другой стороны, зависит от количества пептидных связей.
Аминокислоты, пептиды и белки имеют один общий знаменатель — пептидную связь. Все перечисленные структуры играют чрезвычайно важную роль в мире природы и правильном функционировании нашего организма.
Аминокислоты представляют собой соединения с относительно сложной молекулярной структурой. С химической точки зрения это органические соединения, имеющие по крайней мере одну аминогруппу и одну карбоксильную группу. Их боковые цепи могут иметь разветвленную, линейную или кольцевую структуры. Молекулы аминокислот объединяются, образуя димеры и полимеры с различной длиной цепи и составом.
Пептиды представляют собой структуры, содержащие около 50 аминокислот (максимум до 100), по этой причине их часто называют короткоцепочечными белками. Они участвуют во всех физиологических процессах, в которых они выполняют роль регуляторов и передатчиков. Они образуются в результате реакции конденсации между карбоксильной группой и аминогруппой, т.е. с образованием пептидной связи. Побочным продуктом этой реакции является молекула воды.
Белки представляют собой высокомолекулярные молекулы со сложной структурой. В состав белков входит ряд аминокислот, которые в разном порядке соединяются между собой пептидными связями. Аминокислоты соединяются в белки таким образом, что карбоксильная группа одной аминокислоты присоединяется к аминогруппе другой аминокислоты или к аминогруппе другой молекулы той же аминокислоты – тогда образуется так называемый дипептид, который имеет свободную аминогруппу и карбоксильную группу. Это обеспечивает дальнейшее присоединение дополнительных молекул аминокислот и образование полипептидов.

Найдите свое место в группе PCC. Узнайте о нашем предложении и развивайтесь вместе с нами.
Неоплачиваемая программа летней стажировки для студентов и выпускников всех специальностей.